Ліки від а до я -
Хвороби -
Калькулятор калорій -
Магнітні бурі -
Дієти -
Очищення організму -
Схуднення -
Молочниця
Геморой -
Лікування -
Косметологія -
Поради -
Інсульт -
Інфаркт -
Діабет -
Варикоз -
Вправи -
Covid-19
Ліки та препарати
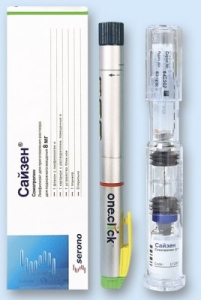
Сайзен
Індастрія Фармацевтика Сероно С. п. А, Італія
Інструкція
Склад.
Діюча речовина: 1 флакон містить 8 мг соматропіну (рекомбінантного людського гормону росту (р-лГР));
допоміжні речовини: сахароза, кислота фосфорна та натрію гідроксид (для доведення рН);
розчинник: один картридж містить 1,37 мл бактеріостатичного розчинника (0,3 % (м./об.) розчину м-крезолу у воді для ін’єкцій).
Лікарська форма. Порошок для приготування розчину для ін'єкцій.
Фармакотерапевтична група. Гормони передньої долі гіпофіза та їх аналоги. Соматропін.
Код АТС Н 01А С 01.
Клінічні характеристики.
Показання.
Недостатній ріст у дітей, спричинений зменшенням або відсутністю секреції ендогенного гормону росту.
Недостатній ріст у дівчаток з дисгенезією гонад (синдром Тернера), підтвердженою хромосомним аналізом.
Недостатній ріст у дітей пре пубертатного віку, спричинений хронічною нирковою недостатністю (ХНН).
Порушення росту у невисоких дітей віком від 4 років та старше (індекс стандартного відхилення (SDS) існуючого росту < -2,5 та з урахуванням росту батьків SDS < -1), які народились зі зростом, що не відповідає гестаційному віку, а маса тіла та/або довжина яких при народженні була менше -2 SD (стандартне відхилення), і які не наздогнали необхідний зріст (SDS швидкості росту < 0 протягом останнього року).
Замісна терапія у дорослих з вираженим дефіцитом гормону росту, діагностованим за разовим динамічним тестом на дефіцит гормону росту.
Протипоказання.
Застосування Сайзену® протипоказане у випадку:
закриття епіфізів у дітей;
відомої гіпер чутливості до соматропіну або будь-якого з інших компонентів порошка або розчинника;
наявності активних новоутворень. Перед початком лікування соматропіном будь-яка протипухлинна терапія повинна бути завершена;
підтвердженого прогресу вання або рецидиву основного внутрішньо черепного ураження;
гострого критичного стану, який розвинувся після відкритої операції на серці, черевній порожнині, внаслідок множинних травм та дихальної недостатності. (Щодо пацієнтів, у яких критичні захворювання розпочались під час лікування соматропіном, див. розділ “Особливості застосування»).
Спосіб застосування та дози.
Лікування слід розпочинати лише при відповідності пацієнтів наступним критеріям:
Дефіцит гормону росту, діагностований у дитинстві
Пацієнти, яким діагноз недостатності гормону росту було поставлено у дитинстві, перед початком гормонозамісної терапії із застосуванням препарату Сайзен® повинні пройти повторне обстеження для підтвердження дефіциту гормону росту.
Дефіцит гормону росту, діагностований у дорослому віці
Пацієнтам має бути поставлений діагноз недостатності гормону росту, спричиненої захворюваннями гіпоталамуса або гіпофіза, та недостатності щонайменше ще одного гормону (за винятком пролактину). Крім того, перед початком застосування гормону росту слід розпочати відповідну гормонозамісну терапію.
Препарат Сайзен® 8 мг клік. ізі призначений для багаторазового дозованого введення.
Дозування препарату Сайзен® повинно підбиратись індивідуально для кожного пацієнта, враховуючи площу поверхні тіла або масу тіла.
Введення препарату Сайзен® рекомендується проводити перед сном у наступних дозуваннях:
Недостатність росту, спричинена недостатньою секрецією ендогенного гормону росту
Підшкірно вводять по 0,7 – 1,0 мг/м2 площі поверхні тіла на добу або по 0,025 – 0,035 мг/кг маси тіла на добу.
Недостатність росту у дівчаток, спричинена дисгенезією гонад (синдром Тернера)
Підшкірно вводять по 1,4 мг/м2 площі поверхні тіла на добу або по 0,045 – 0,050 мг/кг маси тіла на добу.
Проведення одночасної терапії із застосуванням неандроген них анаболічних стероїдів у пацієнток із синдромом Тернера може призводити до посилення реакції на введення гормону росту.
Недостатність росту у дітей пре пубертатного віку, спричинена хронічною нирковою недостатністю (ХНН)
Підшкірно вводять по 1,4 мг/м2 площі поверхні тіла на добу, що приблизно еквівалентно 0,045 – 0,050 мг/кг маси тіла на добу.
Недостатність росту у невисоких дітей, що народились зі зростом, який не відповідає гестаційному віку (НГВ)
Рекомендується щоденне підшкірне введення по 0,035 мг/кг маси тіла (або по 1 мг/м2 площі поверхні тіла, що дорівнює 0,1 МО/кг/добу або 3 МО/м2/добу).
Тривалість лікування
Лікування слід припинити при досягненні пацієнтом росту, достатнього для дорослих, або при закритті епіфізів.
Лікування порушень росту у невисоких дітей, що народилися з НГВ, звичайно рекомендується продовжувати до досягнення пацієнтом кінцевого росту. Лікування слід припинити через 1 рік, якщо SDS швидкості росту буде нижче +1. Лікування слід припинити при досягненні кінцевого росту (визначається як швидкість росту < 2 см/рік). Потребується підтвердження необхідності лікування, якщо розмір кісток відповідає віку >14 років (дівчата) або > 16 років (хлопці), що відповідає закриттю епіфізів.
Дефіцит гормону росту у дорослих
На початку терапії із застосуванням соматропіну рекомендується підшкірно вводити низькі дози препарату, які становлять 0,15 - 0,30 мг гормону росту щоденно. Дозу слід поступово регулювати та контролю вати за рівнями інсуліноподібного фактору росту 1 (IGF-1). Рекомендована кінцева доза гормону росту рідко перевищує 1,0 мг/добу. Загалом слід вводити найнижчі ефективні дози препарату. Для пацієнтів літнього віку або пацієнтів з надлишковою вагою може бути необхідним зменшення доз препарату. Оскільки дефіцит гормону росту у дорослих є довічний, він потребує відповідного лікування. Однак, досвід лікування пацієнтів старше 60 років та досвід тривалого застосування препарату обмежений.
Спосіб приготування розчину та введення ін’єкцій
Препарат слід розчиняти бактеріостатичним розчинником, що додається до упаковки, використовуючи пристрій для розчинення клік. ізі.
Розведений розчин призначений для підшкірного введення; він повинен бути прозорим і не містити часток. Якщо розчин містить частки, його не слід вводити. Розведений розчин має концентрацію 5,83 мг/мл та містить загалом 8 мг соматропіну у флаконі.
Пацієнт повинен бути повністю проінструктований щодо проведення процедури розчинення.
Підготовчий етап
Слід переконатися, що пристрій клік. ізі має повну комплектацію, тобто що в упаковці є флакон з препаратом Сайзен® (а), стерильна перехідна канюля (b) та картридж з розчинником (с).
Слід перевірити, що видимі перетинки на корпусі пристрою клік. ізі (d) та на ковпачку (е) не пошкоджені. Якщо будь-яка з перетинок пошкоджена, препарат не можна використовувати.
Помістіть усі предмети, необхідні для приготування розчину, на чисту поверхню.
Вимийте руки милом та водою.
Приготування розчину для ін’єкцій та наступне введення розчину препарату слід проводити у відповідності до наступних інструкцій:
Помістіть пристрій для розчинення клік. ізі вертикально на рівну поверхню таким чином, щоб флакон знаходився знизу, а ковпачок (g) – зверху.
Натискайте на ковпачок рухом донизу доти, доки він не припинить рухатись далі. (Примітка: зараз видима перетинка на корпусі пристрою клік. ізі зруйнована).
Злегка поверніть ковпачок за годинниковою стрілкою так, щоб зелена позначка (f) була розташована у вертикальному отворі.
Для перенесення розчинника з картриджу у флакон продовжуйте дуже повільно натискати на ковпачок, доки він не перестане пересуватись (Примітка: видима перетинка на ковпачку зараз зруйнована). Для запобігання утворенню піни у флаконі важливо, щоб натискання було повільним. Перевірте, щоб увесь розчинник був перенесений до флакону.
Розчиніть порошок у розчиннику, обережно обертаючи пристрій клік. ізі (Примітка: уникайте енергійного струшування для запобігання утворенню піни). Залишіть розчин на деякий час для повного розчинення порошку.
g. ковпачок
c. картридж з
розчинником
b. стерильна
перехідна
канюля
a. флакон з
препаратом
Сайзен®
e. видима перетинка
f. зелена позначка
d. видима перетинка
Переверніть пристрій клік. ізі догори дном (флакон зверху) та повільно відтягуйте ковпачок донизу, доки розчин повністю не потрапить до картриджа.
Перевірте, щоб у флаконі залишилось не більше однієї або двох крапель розчину. Якщо у флаконі залишилось більше однієї або двох крапель розчину, повільно відтягуйте ковпачок, доки деяка частина розчину не потрапить назад до флакона і обережно постукайте пристрій клік. ізі. Потім повільно відтягніть розчин назад до картриджа.
(Примітка: слід уникати занадто швидкого відтягнення ковпачка, оскільки це призведе до потрапляння повітря до картриджа).
Утримуючи пристрій клік. ізі у цьому положенні (флакон зверху) відгвинтіть ковпачок та зніміть його.
Утримуючи пристрій клік. ізі у такому ж положенні (флакон зверху), видаліть з пристрою картридж, який містить розведений розчин для ін’єкцій.
Обережно зніміть зовнішню етикетку за допомогою «язичка». На прозорій внутрішній етикетці картриджу запишіть дату розведення. Обережно позбавтеся використаного пристрою клік. ізі.
Введення приготованого розчину слід проводити із використанням інжектора автоматичного Оne.clickтм та голок Оne.clickтм або інжектора без голкового автоматичного Сool.clickтм, спеціально призначених для цього.
Примітка: щодо інструкцій, як вставляти картридж до авто інжектору Оne.clickтм або як використовувати без голковий авто інжектор Сool.clickтм і вводити розведений розчин препарату Сайзен®, будь ласка, прочитайте інструкцію з використання, яка надається разом з цими автоматичними інжекторами.
Побічні реакції.
До 10 % пацієнтів можуть відчувати почервоніння та свербіж у місці ін’єкції.
Під час проведення гормонозамісної терапії із застосуванням гормону росту у дорослих спостерігаються явища затримки рідини. Клінічними проявами затримки рідини можуть бути периферічні набряки, набряк суглобів, артралгія, міалгія та парестезія. Однак, ці симптоми/ознаки звичайно мають тимчасовий і дозозалежний характер.
Звичайно для дорослих пацієнтів з дефіцитом гормону росту, у яких цей діагноз був встановлений у дитинстві, повідомляється про меншу частоту розвитку побічних ефектів порівняно із тими, у кого дефіцит гормону росту розвинувся у дорослому віці.
У деяких пацієнтів можуть утворюватись антитіла до соматропіну. Клінічне значення цих антитіл невідоме, хоча до цього часу повідомлялось про низьку зв’язуючу здатність таких антитіл, що не призводило до послаблення росту, за виключенням пацієнтів з делецією відповідних генів. У вкрай поодиноких випадках, коли невисокий зріст спричинений делецією відповідного генного комплексу, лікування гормоном росту може індукувати антитіла, що послаблюють процес росту.
Побічні реакції, про які повідомлялось у зв’язку із застосуванням препарату, і які перелічені нижче, класифікуються відповідно до їх частоти наступним чином:
Дуже поширені ³ /10
Поширені > 1/100 - < 1/10
Нечасті > 1/1000 - < 1/100
Поодинокі > 1/10000 - < 1/1000
Вкрай поодинокі ≤ 1/10 000
Порушення у місці ін’єкції
Поширені
Реакції у місці ін’єкції. Локалізована ліпоатрофія, яку можна попередити змінюванням ділянок для ін’єкцій.
Організм в цілому – загальні розлади
Поширені (у дорослих) та нечасті (у дітей)
Затримка рідини: периферичний набряк, скутість суглобів, артралгія, міалгія, парестезія.
Нечасті
Зап’ястний синдром.
Центральна нервова система
Нечасті
Ідіопатична внутрішньо черепна гіпертензія (доброякісна внутрішньо черепна гіпертензія).
Ендокринні розлади
Вкрай поодинокі
Гіпотиреоз.
М’язово-скелетні порушення
Вкрай поодинокі
Вивих або аваскулярний некроз голівки стегнової кістки.
Розлади метаболізму
Резистентність до інсуліну може призводити до гіперінсулінемії та, у поодиноких випадках, - до гіперглікемії.
Передозування.
Не повідомлялось про жоден випадок гострого передозування препарату. Однак, перевищення рекомендованих доз може спричинити розвиток побічних ефектів. Передозування може призводити до гіпоглікемії з наступною гіперглікемією. Крім того, ймовірно, що передозування соматропіну спричиняє явища затримки рідини.
Застосування у період вагітності або годування груддю.
Вагітність: оскільки клінічні дані щодо впливу препарату Сайзен® на вагітність відсутні, ризики такого застосування невідомі. Хоча у дослідженнях на тваринах не було встановлено потенційного ризику застосування препарату у період вагітності, однак при настанні вагітності таке застосування потрібно припинити.
Лактація: дотепер невідомо, чи виділяються екзогенні пептидні гормони у грудне молоко, але абсорбція інтактних протеїнів з шлунково-кишкового тракту новонароджених є малоймовірною.
Особливості застосування.
Лікування слід проводити під регулярним наглядом лікаря, який має досвід діагностування та лікування пацієнтів з дефіцитом гормону росту.
Пацієнтів з внутрішньо- та зовнішньо черепними новоутвореннями в стадії ремісії, які лікуються гормоном росту, слід обстежувати ретельно та з регулярними інтервалами. У пацієнтів з дефіцитом гормону росту, який спричинений внутрішньо черепними пухлинами, слід проводити часті медичні обстеження для виявлення можливого прогресу вання або рецидивів основного захворювання.
Існує декілька повідомлень про розвиток лейкемії у дітей з дефіцитом гормону росту, деякі з яких проходили курс терапії гормоном росту. Це може свідчити про можливе незначне зростання частоти розвитку цієї патології у дітей з дефіцитом гормону росту, хоча причинний зв’язок між розвитком лейкемії та терапією із застосуванням гормону росту не був встановлений.
Після введення гормону росту спостерігається тимчасова фаза гіпоглікемії, яка триває приблизно 2 год, після чого рівень глюкози в крові збільшується протягом 2 - 4 год, незважаючи на високі концентрації інсуліну. Соматропін може індукувати стан резистентності до інсуліну, що в свою чергу, може призводити до гіперінсулінізму, і у деяких пацієнтів – до гіперглікемії. Для виявлення резистентності до інсуліну пацієнтів слід обстежувати щодо непереносимості глюкози.
Препарат Сайзен® слід застосовувати з обережністю у пацієнтів з цукровим діабетом або з випадками цукрового діабету у родині. Для пацієнтів з цукровим діабетом може бути необхідним корекція їх протидіабетичної терапії.
Наявність у пацієнтів стабільної базисної ретинопатії не повинна призводити до припинення гормонозамісної терапії із застосуванням препарату Сайзен®. У випадку розвитку передпроліферативних змін та за наявності проліферативної ретинопатії гормонозамісну терапію із застосуванням препарату Сайзен® слід припинити.
Протягом лікування соматропіном було встановлено підвищення рівня перетворення Т 4 у Т 3, що може призвести до зменшення сироваткового рівня Т 4 та збільшення сироваткового рівня Т 3. В цілому, периферичні рівні тиреоїдного гормону залишаються в межах відповідного діапазону, притаманному здоровим особам. Вплив соматропіну на рівні тиреоїдного гормону може бути клінічно значущим у пацієнтів з центральним субклінічним гіпотиреозом, у яких теоретично може розвинутися явний гіпотиреоз. І навпаки, у пацієнтів, які проходять курс замісної терапії із застосуванням тироксину, може спостерігатись легка форма гіпертиреозу. Отже, після початку лікування із застосуванням соматропіну та після регулювання його дози наполегливо рекомендується перевіряти тиреоїдну функцію.
У дорослих під час гормонозамісної терапії із застосуванням гормону росту очікується розвиток явищ затримки рідини.
Для того, щоб запобігти розвитку зап’ястного синдрому, у разі розвитку стійкого набряку або тяжкої парестезії слід зменшити дозування препарату.
У разі тяжкого або періодичного головного болю, порушень зору, нудоти та/або блювання рекомендується проведення офтальмоскопії для виявлення можливого набряку зорового нерва. При його підтвердженні та з урахуванням можливого розвитку доброякісної внутрішньо черепної гіпертензії (або псевдо пухлини мозку) лікування препаратом Сайзен® слід припинити. На сьогодні не одержано достатньо доказів, які б клінічно обґрунтовували застосування препарату у пацієнтів з вилікуваною внутрішньо черепною гіпертензією. У разі відновлення терапії із застосуванням гормону росту необхідне проведення ретельного моніторингу симптомів внутрішньо черепної гіпертензії, причому при рецидивах цього стану лікування слід припинити.
Вивих голівки стегнової кістки часто пов'язаний з ендокринними розладами, такими як дефіцит гормону росту та гіпотиреоз, а також зі сплесками росту. У дітей, які лікуються гормоном росту, вивих голівки стегнової кістки може бути спричиненим або основним ендокринним порушенням, або збільшенням швидкості росту, спричиненим лікуванням. Різкі сплески росту можуть збільшувати ризик розвитку патології суглобів, оскільки стегновий суглоб знаходиться під особливим навантаженням під час пре пубертатного сплеску росту. Лікарі та батьки таких дітей, що лікуються препаратом Сайзен®, повинні уважно стежити за своєчасним виявленням ознак кульгавості та скарг на біль у стегнах та колінах.
Пацієнтів з недостатнім ростом, спричиненим хронічною нирковою недостатністю, слід періодично обстежувати з метою можливого підтвердження прогресу вання ниркової остеодистрофії. У дітей з вираженою нирковою остеодистрофією може спостерігатись вивих або аваскулярний некроз голівки стегнової кістки, причому ще не з’ясовано, чи існує причинний зв'язок між цими порушеннями та терапією ГР. Тому перед початком терапії слід провести рентгенологічне обстеження стегна.
Дітям з хронічною нирковою недостатністю препарат призначають при зниженні функції нирок більше ніж на 50 % від норми. Для підтвердження порушень росту перед призначенням терапії слід контролю вати ріст дітей протягом року. Протягом одного року перед початком лікування соматропіном потрібно призначити консервативне лікування ниркової недостатності (яке включає контроль ацидозу, гіперпаратиреозу та режиму харчування), якого слід дотримуватись і протягом всього терміну терапії гормоном росту. На час проведення трансплантації нирки лікування необхідно припинити.
У невисоких дітей, народжених з невідповідністю росту їхньому гестаційному віку (НГВ), перед початком лікування слід виключити наявність інших медичних причин, які б могли пояснити існуюче порушення росту.
Для пацієнтів з НГВ перед початком терапії та щорічно протягом лікування рекомендується вимірювати рівні інсуліну та глюкози у крові. У пацієнтів з підвищеним ризиком розвитку цукрового діабету (наприклад, сімейні випадки діабету, ожиріння, підвищений індекс маси тіла, тяжка форма резистентності до інсуліну, акантокератодермія) слід проводити тести на пероральну переносимість глюкози (ТППГ). Гормон росту не слід призначати при явному цукровому діабеті.
Для пацієнтів з НГВ рекомендується вимірювати рівень IGF-1 перед початком лікування та потім двічі на рік. Якщо при повторному вимірюванні рівень IGF-1 перевищує +2 SD порівняно зі значеннями, що відповідають віку та статі пацієнта, слід відкоригувати дозу препарату з урахуванням співвідношення IGF-1/IGFBR-3.
Досвід лікування пацієнтів з НГВ, початок якого наближається до початку їхнього статевого дозрівання, обмежений. Отже, розпочинати лікування у цей час не рекомендується. Досвід лікування пацієнтів з НГВ та синдромом Сильвера-Расселя також обмежений.
Ефект від лікування соматропіном дітей з НГВ може бути деякою мірою втрачено, якщо лікування припинити до досягнення ними кінцевого росту.
Для запобігання розвитку ліпоатрофії слід змінювати місце ін’єкції.
При застосуванні соматропіну у пацієнтів, у яких протягом лікування розвивається гострий критичний стан, слід враховувати очікувану користь і потенційний ризик такого лікування (див. розділ «Протипоказання»).
Повідомлялось про випадки зупинки дихання уві сні та раптову смерть пацієнтів із синдромом Прадера-Віллі, які застосовували соматропін. Препарат Сайзен® не показаний для лікування таких пацієнтів.
Здатність впливати на швидкість реакції при керуванні авто транспортом або іншими механізмами.
Препарат Сайзен® не впливає на здатність пацієнта керувати автомобілем або працювати з механізмами.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Одночасна терапія із супутнім застосуванням кортикостероїдів може інгібувати відповідь на лікування препаратом Сайзен®.
Повідомлялось, що соматропін індукує помірне зниження сироваткового рівня кортизолу у пацієнтів з дефіцитом гормону росту, які проходять курс замісної терапії препаратами гормонів надниркових залоз. Отже, у таких пацієнтів, які розпочали курс терапії із застосуванням препарату Сайзен®, рекомендується контролю вати сироватковий рівень кортизолу та при необхідності регулювати дозу кортикостероїдів.
Гормон росту може бути індуктором цитохрому Р 450 3А 4. Клінічне значення цього спостереження невідоме. Однак, у випадках, коли соматропін вводиться в комбінації з препаратами, які метаболізуються печінковими ферментами системи СYP Р 450 3А 4, доцільним є проведення контролю клінічної ефективності таких препаратів.
Фармакологічні властивості.
Фармакодинаміка. Препарат містить рекомбінантний гормон росту людини (р-лГР), вироблений генно-інженерними методами з клітин ссавців. р-лГР - це пептид, що складається з 191 амін окислоти та є ідентичним до людського гіпофізарного гормону росту за амін окислотною послідовністю та складом, а також за картою пептидів, ізоелектричною точкою, молекулярною вагою, ізомерною структурою та біоактивністю.
Діюча речовина препарату є анаболічним та антикатаболічним агентом, який впливає не лише на ріст, але й також на будову тіла та метаболізм. Він взаємодіє зі специфічними рецепторами на клітинах різного типу, включаючи міоцити, гепатоцити, адипоцити, лімфоцити та гематопоетичні клітини. Деякі з таких ефектів опосередкуються іншим класом гормонів, відомим як соматомедини (IGF-1 та IGF-2).
Залежно від величини введеної дози, препарат спричиняє підвищення рівнів IGF-1, IGFBP-3, неетирифікованих жирних кислот та гліцерину, зниження рівнів сечовини в крові та азоту в сечі, а також зменшення виведення натрію та калію. Тривалість підвищення рівнів гормону росту (ГР) може відігравати важливу роль у визначенні ступеню його ефективності. Для високих доз препарату ймовірно існування явища відносного насичення його ефекту. Але це не стосується глікемії та сечового виведення С-пептиду, які значно підвищуються лише після введення високих доз препарату (20 мг).
Фармакокінетика. Фармакокінетика препарату має лінійний характер щонайменше при застосуванні доз до 8 МО (2,67 мг). При застосуванні більш високих доз (60 МО/20 мг) не можна виключати деякої не лінійності відповіді, яка, однак, не має клінічного значення.
Після внутрішньо венного введення препарату здоровим добровольцям об’єм розподілу у рівноважному стані становить приблизно 7 л; загальний метаболічний кліренс - приблизно 15 л/год, тоді як нирковий кліренс є незначним. Період напів виведення препарату становить 20 – 35 хв.
Після разового підшкірного та внутрішньом’язового введення препарату уявний кінцевий період напів виведення є більш тривалим і становить приблизно від 2 до 4 год. Таке збільшення зумовлено процесом абсорбції препарату, що обмежує швидкість його виведення.
Максимальні сироваткові концентрації ГР досягаються приблизно через 4 год після введення, потім сироватковий рівень ГР повертається до базового протягом 24 год, що свідчить про відсутність кумуляції ГР під час повторного введення.
Абсолютна біодоступність препарату для обох шляхів введення становить 70 – 90 %.
Фармацевтичні характеристики.
Основні фізико-хімічні властивості: біла або майже біла ліофілізована речовина.
Несумісність.
Не відома
Термін придатності.
Термін придатності - 3 роки.
Готовий розчин слід зберігати при температурі 2 – 8 º (у холодильнику) максимально впродовж 28 днів.
Умови зберігання.
Зберігати у недоступному для дітей місці.
Зберігати при температурі не вище 25 º С в оригінальній упаковці.
Не заморожувати.
Упаковка.
1 флакон з порошком для приготування розчину для ін’єкцій у комплекті з 1 картриджем з 1,37 мл бактеріостатичного розчинника для парентерального застосування (0,3 % (м./об.) розчин м-крезолу у воді для ін’єкцій), які попередньо зібрані в 1 пристрій для розчинення (клік. ізі), що складається з 1 корпусу пристрою та 1 стерильної перехідної канюлі.
5 флаконів з порошком для приготування розчину для ін’єкцій у комплекті з 5 картриджами з 1,37 мл бактеріостатичного розчинника для парентерального застосування (0,3 % (м./об.) розчин м-крезолу у воді для ін’єкцій), які попередньо зібрані в 5 пристроїв для розчинення (клік. ізі), що складаються з 5 корпусів пристрою та 5 стерильних перехідних канюль.
Категорія відпуску. За рецептом.
Виробник. Індастрія Фармацевтика Сероно С. п. А. /
Industria Farmaceutica Serono S.p.A.
Місцезнаходження. Зона Індустріале ді Модуньо, 70123 Барі, Італія /
Zona Industriale di Modugno, 70123 Bari, Italy.
| Кількість переглядів: |