Ліки від а до я -
Хвороби -
Калькулятор калорій -
Магнітні бурі -
Дієти -
Очищення організму -
Схуднення -
Молочниця
Геморой -
Лікування -
Косметологія -
Поради -
Інсульт -
Інфаркт -
Діабет -
Варикоз -
Вправи -
Covid-19
Ліки та препарати
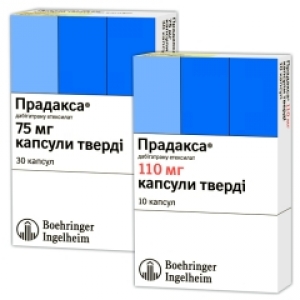
Прадакса
Берінгер Інгельхайм Фарма ГмбХ і Ко. КГ, Німеччина
Інструкція
Склад:
діюча речовина: дабігатрану етексилат;
1 капсула містить дабігатрану етексилату мезилату 86,48 мг або 126,83 мг еквівалентно 75 мг або 110 мг дабігатрану етексилату;
допоміжні речовини: акація, кислота винна, гіпромелоза, диметикон, тальк, гідроксипропіл целюлоза; оболонка капсули: карагінан (Е 407), калію хлорид, титану діоксид (E 171), індигокармін (E 132), жовтий захід FCF (E 110), гіпромелоза, вода очищена; фарба для друку (пропіленгліколь (E1520).
Лікарська форма. Капсули тверді.
Фармакотерапевтична група. Антитромботичні агенти. Прямі інгібітори тромбіну.
Код ATC B01A E07.
Клінічні характеристики.
Показання. Запобігання венозним тромбоемболічним ускладненням у пацієнтів, які перенесли обширну ортопедичну операцію.
Протипоказання.
Відома підвищена чутливість до дабігатрану або дабігатрану етексилату, або до одного з інгредієнтів препарату.
Тяжкі порушення функції нирок (кліренс креатині ну < 30 мл/хв).
Ознаки кровотечі, геморагічний діатез, порушення гемостазу.
Ураження органів з ризиком появи клінічно значущої кровотечі, включаючи геморагічний інсульт за останні 6 місяців.
Пацієнти з постійним спінальним чи епідуральним катетером та протягом першої години після вилучення катетера (див. розділ „Особливості застосування”).
Дитячий вік.
Спосіб застосування та дози.
Дорослі та люди літнього віку.
Запобігання венозному тромбоемболізму (далі - ВТЕ) у пацієнтів після обширної ортопедичної операції. Рекомендована доза дабігатрану етексилату становить 220 мг один раз на день – 2 капсули по 110 мг. Пацієнти з помірними порушеннями функції нирок мають підвищений ризик появи кровотечі. Для таких пацієнтів рекомендована доза дабігатрану етексилату становить 150 мг один раз на день – 2 капсули по 75 мг.
Запобігання ВТЕ після хірургічної операції із заміни колінного суглоба. Застосування дабігатрану етексилату слід розпочати перорально через 1–4 години після завершення операції по 1 капсулі (по 110 мг) та після цього продовжувати приймати по 2 капсули один раз на день, всього протягом 10 днів. Якщо не відбувся гемостаз у ділянці поверхні рани, то початок лікування слід відкласти. Якщо лікування не розпочалося в день операції, тоді слід розпочати з 2 капсул на день.
Запобігання ВТЕ після хірургічної операції із заміни тазостегнового суглоба. Лікування дабігатрану етексилатом слід розпочати перорально через 1–4 години після завершення операції по 1 капсулі (по 110 мг) та після цього продовжувати приймати по 2 капсули один раз на день, всього протягом 28 – 35 днів. Якщо не відбувся гемостаз у ділянці поверхні рани, то початок лікування слід відкласти. Якщо лікування не розпочалося в день операції, тоді слід розпочати з 2 капсул на день.
Дабігатрану етексилат слід запивати водою, незалежно від прийому їжі.
Пацієнти з порушеннями функції печінки. Пацієнти з помірними та тяжкими порушеннями функції печінки (за класифікацією Чайлда-П’ю, B та C) чи із захворюваннями печінки, які, за очікуваннями, матимуть будь-який вплив на виживання, чи з підвищеним рівнем ферментів печінки, що більше ніж у 2 рази перевищував верхню межу норми (ВМН), були виключені з клінічних досліджень. Тому прийом дабігатрану етексилату не рекомендований для цієї групи пацієнтів.
Пацієнти з порушеннями функції нирок. Пацієнти з помірними порушеннями функції нирок (кліренс креатині ну 30-50 мл/хв) мають підвищений ризик появи кровотечі. Пацієнтам з помірними порушеннями функції нирок дозу слід знизити до 150 мг дабігатрану етексилату щоденно. Кліренс креатині ну можна підрахувати за допомогою формули Кокрофта-Голта таким чином:
Кліренс креатині ну (мл/хв) =
Немає жодних даних на підтримку застосування пацієнтами з тяжкими порушеннями функції нирок, кліренс креатині ну < 30мл/хв. Прийом дабігатрану етексилату в такій групі пацієнтів не рекомендується.
Дабігатран можна вивести за допомогою діалізу; не існує клінічного досвіду, щоб продемонструвати застосування цього підходу в клінічних дослідженнях.
Супутнє застосування дабігатрану етексилату з аміодароном або верапамілом. Для пацієнтів, які приймають дабігатрану етексилат з аміодароном або верапамілом, дозу дабігатрану етексилату потрібно зменшити до 150 мг на добу.
Перехід з прийому дабігатрану етексилату на прийом парентерального антикоагулянта. Перед переходом від прийому дабігатрану етексилату на парентеральний антикоагулянт слід зачекати 24 години після прийому останньої дози.
Перехід від лікування парентеральними коагулянтами до прийому дабігатрану етексилату. Немає жодних даних, тому не рекомендується розпочинати прийом дабігатрану етексилату раніше наступної за розкладом дози парентерального антикоагулянта.
Побічні реакції. Побічні реакції, які впевнено можна віднести до таких, що мають відношення до дабігатрану та з’являлися з однаковою частотою для еноксапарину, – це кровотечі чи ознаки кровотечі, зокрема анемія та виділення з рани.
Критерії оцінки частоти розвитку побічної реакції лікарського засобу:
понад 10% - дуже часті;
1-10% - часті;
0,1-1% - нечасті;
0,01-0,1% - поодинокі;
менше 0,01% - рідкісні.
З боку системи крові та лімфатичної системи.
Нечасті: анемія;
поодинокі: тромбоцит опенія.
З боку серцево-судинної системи.
Нечасті: гематома, крововилив у рані;
поодинокі: крововилив.
З боку дихальної системи.
Нечасті: носові кровотечі.
З боку травної системи.
Нечасті: шлунково-кишкові кровотечі, ректальні кровотечі, гемороїдальні кровотечі.
Нечасті: порушення функції печінки.
З боку шкіри і підшкірної клітковини.
Нечасті: крововиливи на шкірі.
З боку опорно-рухової системи та сполучної тканини.
Нечасті: гемартроз.
З боку сечовидільної системи.
Нечасті: гематурія.
Загальні розлади та порушення у місці введення.
Нечасті: кров’янисті виділення;
поодинокі: крововилив у місці ін’єкції, крововилив у місці введення катетера.
Ушкодження та ускладнення при проведенні процедур.
Нечасті: виділення в рані, пост процедурна гематома, пост процедурний крововилив, пост операційна анемія, травматична гематома, пост процедурні виділення;
поодинокі: крововилив у місці розрізу.
Хірургічні та медичні процедури.
Нечасті: дренаж рани;
поодинокі: пост процедурний дренаж.
Частота появи побічних ефектів дабігатрану етексилату, що спостерігалась, була в діапазоні побічних реакцій еноксапарину.
Передозування. Не існує антидоту для дабігатрану етексилату чи дабігатрану. Дози дабігатрану етексилату, що перевищують рекомендовані, призводять до підвищення ризику кровотечі. У випадку геморагічних ускладнень лікування слід припинити та з’ясувати джерело кровотечі. Оскільки дабігатран виводиться, головним чином, нирками, то слід підтримувати адекватний діурез. Слід розглянути проведення відповідного лікування, наприклад, хірургічного гемостазу чи трансфузії свіжозамороженої плазми.
Клінічного досвіду щодо застосування діалізу немає.
Застосування у період вагітності або годування груддю.
Жінкам репродуктивного віку слід уникати вагітності протягом лікування дабігатрану етексилатом. Вагітним жінкам не слід лікуватись дабігатрану етексилатом, окрім випадку, коли очікувана користь для матері буде перевищувати потенційний ризик для плода.
Період годування груддю. Немає даних. Як застереження слід припинити годування груддю.
Діти. Дабігатрану етексилат не досліджувався за участю пацієнтів віком до 18 років. Дабігатрану етексилат не застосовують дітям.
Особливості застосування.
Порушення функції печінки. Пацієнти з помірними та тяжкими порушеннями функції печінки (за класифікацією Чайлда-П’ю, B та C) чи із захворюваннями печінки, які, як припускалось, мали вплив на виживання, чи з підвищеним рівнем ферментів печінки, що більше ніж у 2 рази перевищував верхню межу норми (ВМН), були виключені з клінічних досліджень. Тому прийом дабігатрану етексилату не рекомендований для цієї групи пацієнтів.
Ризик кровотечі. Не слід приймати супутньо з дабігатрану етексилатом такі препарати: нефракційні гепарини та похідні гепарину, низь комолекулярні гепарини, фондапаринукс, дезирудин, тромболітичні препарати, антагоністи рецепторів GPIIb/IIIa, клопідогрель, тиклопідин, декстран, сульфінпіразон та антагоністи вітаміну K. Слід зауважити, що нефракційні гепарини можна приймати в дозах, необхідних для підтримання прохідності центрального венозного або артеріального катетера.
Було показано, що ацетил саліцилова кислота в дозах 75-325 мг підвищує ризик появи кровотечі, якщо її приймають супутньо з дабігатрану етексилатом в дозах, які перевищують рекомендовані для запобігання ВТЕ. При прийомі рекомендованої дози дабігатрану етексилату не було жодних доказів надмірного ризику появи кровотечі, притаманного для дабігатрану, у пацієнтів, які приймали низьку дозу ацетил саліцилової кислоти для запобігання серцево-судинним явищам. Однак ця інформація є обмеженою, а для пацієнтів, які супутньо приймають низьку дозу ацетил саліцилової кислоти і дабігатрану етексилату, повинно проводитись клінічне спостереження на предмет кровотечі.
Ретельне спостереження (на предмет ознак кровотечі чи анемії) є необхідним у таких ситуаціях, що можуть підвищити ризик появи кровотечі:
Нещодавня біопсія чи значна травма.
Пацієнти, які приймають препарати, що можуть підвищити ризик появи кровотечі. Взаємозв’язок дабігатрану етексилату з препаратами, що впливають на гемостаз чи коагуляцію, може підвищити ризик появи кровотечі (див. розділ „Взаємодія з іншими лікарськими засобами та інші види взаємодій”).
Було показано, що не стероїдні протизапальні препарати, що застосовувались для короткочасної інтраопераційної аналгезії, не пов’язані з підвищеним ризиком появи кровотечі, коли їх приймають разом з дабігатрану етексилатом. Існують обмежені дані щодо регулярного застосування не стероїдного проти запального препарату з періодом напів виведення менше 12 годин, під час застосування дабігатрану етексилату, і ці дані не свідчать про додатковий ризик появи кровотечі.
Пероральне застосування сильного інгібітора P-глікопротеїну (наприклад, верапамілу) разом з дабігатрану етексилатом як супутнім препаратом може підвищувати концентрації дабігатрану в плазмі, що спричиняє підвищення ризику кровотечі. Призначення лікування верапамілом слід уникати пацієнтам, які перенесли обширну ортопедичну операцію і приймають дабігатрану етексилат. Також слід уникати одночасного початку лікування дабігатрану етексилатом і верапамілом.
Бактеріальний ендокардит.
Ниркова недостатність. Фармакокінетичні дослідження продемонстрували збільшення терміну дії препарату у пацієнтів зі зниженою функцією нирок, включаючи вікове зниження функції нирок. Для пацієнтів з помірними порушеннями функції нирок (50-30 мл/хв) рекомендується зниження дози до 150 мг щоденно. Дабігатрану етексилат протипоказаний у випадках тяжкого порушення функції нирок (кліренс креатині ну < 30 мл/хв). Пацієнти, у яких розвинулась гостра ниркова недостатність, повинні припинити приймати дабігатрану етексилат.
Спинномозкове знеболення/епідуральна анестезія/люмбальна пункція. Ризик появи спинномозкової чи епідуральної гематоми може підвищитись у випадках травматичної чи повторної пункції та подовженого після операційного застосування епідуральних катетерів. Після вилучення катетера слід зачекати щонайменше 1 годину до прийому першої дози дабігатрану етексилату. Такі пацієнти потребують ретельного спостереження неврологічних симптомів.
Препарат містить неактивний інгредієнт жовтий захід FCF (E 110), який може спричинити алергічні реакції.
Здатність впливати на швидкість реакції при керуванні авто транспортом або роботі з іншими механізмами. Не досліджувалась.
Взаємодія з іншими лікарськими засобами та інші види взаємодій. Супутнє застосування дабігатрану етексилату з лікарськими засобами, що впливають на гемостаз чи коагуляцію, включаючи антагоністи вітаміну K, може помітно підвищити ризик появи кровотечі (див. розділ „Особливості застосування”).
Дабігатрану етексилат та дабігатран не метаболізуються системою цитохрому P450 та не мали in vitro жодного впливу на ферменти цитохрому P450. Тому не очікується взаємодія дабігатрану етексилату чи дабігатрану з відповідними лікарськими засобами.
Аміодарон: коли дабігатрану етексилат застосовували супутньо з разовою дозою аміодарону 600 мг, то об’єм та швидкість всмоктування аміодарону та його активного метаболіту діетанол аміну (DEA) не змінювались суттєво. Площа під кривою „концентрація-час” (AUC) та максимальна концентрація дабігатрану в плазмі крові (Cmax) збільшились приблизно на 60% та 50% відповідно, але коригування дози не рекомендується.
Верапаміл: при супутньому прийомі дабігатрану етексилату і верапамілу для перорального застосування, Cmax і AUC дабігатрану збільшувалися залежно від розрахунку часу прийому та лікарської форми верапамілу.
Найсильніша дія дабігатрану спостерігалася при прийомі першої дози верапамілу з негайним вивільненням, що застосовувалася за одну годину до прийому дабігатрану етексилату (збільшення Cmax приблизно на 180% і AUC приблизно на 150%). Ефект поступово зменшувався при прийомі верапамілу з тривалим вивільненням (збільшення Cmax приблизно на 90% і AUC приблизно на 70%) або введенні багаторазових доз верапамілу (збільшення Cmax приблизно на 60% і AUC приблизно на 50%). Це може пояснюватися індукцією P-глікопротеїну у травному тракті при тривалому лікуванні верапамілом.
Значущої взаємодії не спостерігалося при прийомі верапамілу через 2 години після прийому дабігатрану етексилату (збільшення Cmax приблизно на 10% і AUC приблизно на 20%). Це пояснюється повним всмоктуванням дабігатрану через 2 години (див. розділ «Спосіб застосування та дози»).
Даних про парентеральне застосування верапамілу немає; з огляду на механізм, значущої взаємодії не очікується.
Кларитроміцин: при супутньому застосуванні кларитроміцину в дозі 500 мг з дабігатрану етексилатом клінічно значущої фармакокінетичної взаємодії не спостерігалося (збільшення Cmax приблизно на 19% і AUC приблизно на 15%).
Аторвастатин: коли дабігатрану етексилат застосовували разом з аторв астатином, то експозиції для аторвастатину, метаболітів аторвастатину та дабігатрану залишились незмінними, що вказувало на відсутність взаємодії.
Диклофенак: коли дабігатрану етексилат приймали разом з диклофенаком, фармакокінетика обох препаратів залишалась незмінною, вказуючи на відсутність взаємодії між дабігатрану етексилатом та диклофенаком. Супутній прийом не стероїдних протизапальних препаратів для короткочасної інтраопераційної аналгезії не пов’язаний з підвищеним ризиком появи кровотечі. Існує обмежений досвід щодо безпечності дабігатрану етексилату у комбінації з не стероїдними протизапальними препаратами під час тривалого чи регулярного застосування, рекомендується спостереження на предмет ознак кровотечі (див. розділ „Особливості застосування”).
Дигоксин: не спостерігалось фармакокінетичної взаємодії при застосуванні дабігатрану етексилату в комбінації з дигоксином.
Пантопразол: при застосуванні дабігатрану етексилату в комбінації з пантопразолом спостерігалося зменшення AUC для дабігатрану приблизно на 30%. У клінічних випробуваннях пантопразол та інші інгібітори протонної помпи приймали супутньо з дабігатрану етексилатом, що однак не зумовило кровотечу і не вплинуло на ефективність.
Ранітидин: супутній прийом ранітидину і дабігатрану етексилату не дав клінічно важливого ефекту на об’єм всмоктування дабігатрану.
Фармакологічні властивості.
Дабігатрану етексилат належить до низь комолекулярних проліків, які не проявляють фармакологічної активності. Після перорального прийому дабігатрану етексилат швидко всмоктується та в плазмі і в печінці перетворюється на дабігатран шляхом каталізованого естеразою гідролізу. Дабігатран є сильним, конкурентним, зворотним прямим інгібітором тромбіну та головною активною речовиною в плазмі.
Оскільки тромбін (серин-протеаза) активує перетворення фібриногену в фібрин у системі згортання крові, то його пригнічення запобігає розвитку тромбу. Дабігатран також інгібує вільний тромбін, фібринзв’язаний тромбін та спричинену тромбіном агрегацію тромбоцитів.
Існує тісний зв’язок між концентрацією дабігатрану в плазмі та ступенем антикоагулянтного ефекту.
Дабігатран подовжує активований частково тромбопластиновий час (АЧТЧ).
У пацієнтів з кровотечею АЧТЧ може бути корисним помічником у визначенні надлишку антикоагулянтної активності – незважаючи на те, що АЧТЧ є менш чутливим до активності дабігатрану на рівні супратерапевтичних доз. При наявності тромбі новий час (TЧ) та екариновий час згортання крові (EЧЗ) можуть бути чутливішими аналізами для оцінки антикоагулянтної дії дабігатрану. Протромбі новий час (МНВ) подовжується через дію дабігатрану, але він є менш чутливим, ніж TЧ та EЧЗ.
Клінічні дослідження профілактики ВТЕ після значної хірургічної операції із заміни суглоба. Результати дослідженнь показали, що антитромботичний ефект обох доз дабігатрану етексилату статистично не поступався ефекту еноксапарину.
Фармакокінетика. Після перорального введення дабігатрану етексилату фармакокінетичний профіль дабігатрану в плазмі характеризується швидким збільшенням концентрації, з досягненням Cmax через 0,5-2 години після введення. Після досягнення Cmax концентрація дабігатрану в плазмі знижується біекспоненціально з середнім кінцевим періодом напів виведення приблизно 14-17 годин у молодих здорових добровольців та 12-14 годин в осіб літнього віку. Період напів виведення був незалежним від дози. Cmax та AUC були пропорційні дозуванню. Прийом їжі не впливає на біодоступність дабігатрану етексилату, але затримує час до пікових концентрацій у плазмі на 2 години.
Абсолютна біодоступність дабігатрану після перорального введення дабігатрану етексилату становила приблизно 6,5%.
Оцінене в дослідженні пост операційне всмоктування дабігатрану етексилату через 1-3 години після хірургічної операції показало відносно низьке всмоктування порівняно з абсорбцією у здорових добровольців, показуючи рівний профіль AUC без високих пікових концентрацій у плазмі. Пікові концентрації у плазмі досягаються через 6 годин після введення або через 7-9 годин після хірургічної операції (BISTRO Ib). Однак слід зауважити, що такі сприятливі фактори, як анестезія, шлунково-кишковий парез та хірургічне втручання будуть означати, що певний відсоток пацієнтів матиме незалежну затримку в абсорбції препарату. Хоча це дослідження не передбачило, чи існує порушення абсорбції наступних доз, але в додатковому дослідженні було показано, що повільне та затримане всмоктування зазвичай присутнє тільки в день хірургічної операції. У наступні дні всмоктування дабігатрану є швидким, з піковими концентраціями в плазмі, що досягаються через 2 години після введення препарату.
Метаболізм та виведення дабігатрану вивчали після одноразової внутрішньо венної дози радіо міченого дабігатрану здоровим чоловікам. Після внутрішньо венного введення радіо активний дабігатран, головним чином, виводився із сечею (85%). Виведення з фекаліями становило 6% від уведеної дози. Відновлення вихідної радіо активності до рівня 88-94 % відбувалося через 168 годин після прийому дабігатрану.
Після перорального введення дабігатрану етексилат швидко та повністю перетворюється на дабігатран, який є активною формою в плазмі. Перетворення про лікарського засобу дабігатрану етексилату шляхом каталізованого естеразою гідролізу на активну речовину дабігатран є домінантною метаболічною реакцією. Дабігатран кон’югується, формуючи фармакологічно активні ацилглюкуроніди. Існують чотири позиційні ізомери, 1-O, 2-O, 3-O, 4-O-ацилглюкуроніди, кожний становить менше 10% від загального дабігатрану в плазмі. Сліди інших метаболітів можна було виявити тільки за допомогою високочутливих аналітичних методів. Дабігатран, головним чином, виводиться у незміненому вигляді з сечею, при швидкості приблизно 100 мл/хв, що відповідає швидкості клуб очкової фільтрації.
Спостерігалось низьке (34-35%), незалежне від концентрації, зв’язування дабігатрану з білками плазми людини. Об’єм розподілу дабігатрану 60–70 л перевищував об’єм загальної рідини організму, вказуючи на помірний розподіл дабігатрану в тканинах.
Фармацевтичні характеристики.
Основні фізико-хімічні властивості:
капсули по 75 мг, довгасті капсули НРМС (розмір 2) з непрозорою кришечкою світло-блакитного кольору та непрозорою основою кремового кольору; кришечка: чорний відтиск символа компанії Берінгер Інгельхайм; основа: чорний відтиск “R75”; вміст: жовтуваті пелети;
капсули по 110 мг, довгасті капсули НРМС (розмір 1) з непрозорою кришечкою світло-блакитного кольору та непрозорою основою кремового кольору; кришечка: чорний відтиск символа компанії Берінгер Інгельхайм; основа: чорний відтиск “R110”; вміст: жовтуваті пелети.
Термін придатності.
Капсули у блістері. 3 роки.
Капсули у флаконі. 3 роки. Використати протягом 30 діб після першого відкривання флакона.
Умови зберігання.
Капсули у блістері.
Зберігати в оригінальній упаковці для захисту від вологи, при температурі не вище 25 °С. Зберігати у місці, недоступному для дітей!
Капсули у флаконі.
Зберігати у щільно закритому флаконі в оригінальній упаковці для захисту від вологи, при температурі не вище 25 °С. Зберігати у місці, недоступному для дітей!
Упаковка.
По 10 капсул у блістері; по 1 або 3, або 6 блістерів у коробці;
по 60 капсул у флаконі; по 1 флакону в коробці.
Категорія відпуску.
За рецептом.
Виробник.
Берінгер Інгельхайм Фарма ГмбХ і Ко. КГ, Німеччина.
Місцезнаходження.
Binger Strasse 173, D-55216, Ingelheim am Rhein, Germany.
Бінгер Штрассе 173, D-55216 Інгельхайм-на-Рейні, Німеччина.
Заявник.
Берінгер Інгельхайм Інтернешнл ГмбХ, Німеччина.
Місцезнаходження.
Binger Strasse 173, D-55216, Ingelheim am Rhein, Germany.
Бінгер Штрассе 173, D-55216 Інгельхайм-на-Рейні, Німеччина.
| Кількість переглядів: |