Ліки від а до я -
Хвороби -
Калькулятор калорій -
Магнітні бурі -
Дієти -
Очищення організму -
Схуднення -
Молочниця
Геморой -
Лікування -
Косметологія -
Поради -
Інсульт -
Інфаркт -
Діабет -
Варикоз -
Вправи -
Covid-19
Ліки та препарати
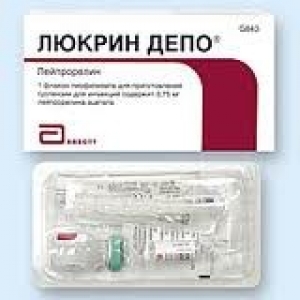
Люкрин
Такеда Фармасьютікал Компані Лтд, Японія
Інструкція
Cклад:
діюча речовина: лейпроліду ацетат;
1 флакон або 1 попередньо-наповнений двокамерний шприц містить 3,75 мг лейпроліду ацетату;
допоміжні речовини: желатин, сополімер DL-молочної та гліколевої кислот (75:25), маніт
(Е 421);
розчинник (2 мл в ампулі або 1 мл у попередньо-наповненому двокамерному шприці): натрію карбоксим етилцелюлоза, маніт (Е 421), полісорбат 80, вода для ін'єкцій, кислота оцтова.
Лікарська форма. Порошок ліофілізований для приготування суспензії для ін'єкцій.
Фармакотерапевтична група. Аналоги гонадотропін-рилізинг гормону.
Код АТС L02A E02.
Клінічні характеристики.
Показання.
Рак передміхурової залози:
метастазую чий рак передміхурової залози;
поширений рак передміхурової залози (паліативне лікування) як альтернативний метод лікування, коли орхіектомія або лікування естрогенами не показані або не можуть застосовуватися для лікування пацієнта;
місцево поширений рак передміхурової залози як альтернатива хірургічній кастрації;
місцевий рак передміхурової залози з високим ризиком та місцево поширений рак передміхурової залози як ад’ювантна терапія у комбінації з опроміненням;
місцево поширений рак передміхурової залози з високим ризиком прогресу вання захворювання як ад’ювантна терапія у комбінації з радикальною простатектомією.
Ендометріоз:
основна терапія або доповнення до хірургічного лікування, включаючи полегшення болю та зменшення патологічних проявів ендометріозу;
комбінована терапія з норетиндрону ацетатом для первинного лікування ендометріозу та рецидивуючих симптомів (тривалість первинного або повторного лікування повинна становити не більше 6 місяців);
Фіброміома матки (термін застосування – до 6 місяців) як передопераційна підготовка перед видаленням міоми або гістеректомією, а також для симптоматичного поліпшення стану жінок у пери менопаузі при відмові від хірургічного втручання;
Рак молочної залози в пре- та перименопаузальному періоді у жінок, яким показана гормональна терапія;
Центральне передчасне статеве дозрівання у дітей.
Протипоказання.
Гіпер чутливість до лейпроліду ацетату, подібних нонапептидів, або до
будь-якого допоміжного інгредієнта препарату.
Гіпер чутливість до гонадотропін-рилізинг гормону, аналогів агоністів
гонадотропін-рилізинг гормону у дітей.
Вагітність (див. відповідний розділ).
Пацієнтки з не уточненою вагінальною кровотечею.
Спосіб застосування та дози.
Лейпроліду ацетат повинен застосовуватися під наглядом лікаря.
Місце ін'єкції слід періодично змінювати.
Не зважаючи на те, що суспензія стабільна протягом 24 годин, якщо суспензія не була використана одразу, її необхідно знищити.
Рак передміхурової залози/Ендометріоз/Фіброміома матки/Рак молочної залози
Застосовують у вигляді внутрішньом'язової або підшкірної ін’єкції один раз на місяць. Рекомендована разова доза Люкрину Депо при ендометріозі, фіброміомі матки, раку молочної залози, раку передміхурової залози – 3, 75 мг.
При комбінації Люкрину Депо з норетиндрону ацетатом для лікування ендометріозу: Люкрин Депо 3,75 мг 1 раз на місяць, норетиндрону ацетат – 5 мг на день (див. інструкцію для медичного застосування).
Діти з центральним передчасним статевим дозріванням
Дозування слід розраховувати індивідуально у мг/кг маси тіла дитини.
Початкова доза
Рекомендована початкова доза становить 0,3 мг/кг раз на 4 тижні.
У таблиці наведені початкові дози відповідно до маси тіла дитини.
Маса тіла Фактична доза Загальна доза
До 25 кг 3,75 мг х 2 7,5 мг
25 – 37,5 кг 3,75 мг х 3 11,25 мг
Більше 37,5 кг 3,75 мг х 4 15 мг
Примітка: у разі, якщо необхідну дозу не можна забезпечити однією ін’єкцією (у концентрації 3,75 мг/мл), доза повинна бути введена у вигляді кількох ін’єкцій одночасно.
Підтримуюча доза
Якщо не досягнуто бажаного результату, дозу необхідно збільшувати на 3,75 мг кожні 4 тижні. Ця доза буде вважатися підтримуючою.
Через один або два місяці після початку терапії або зміни дози необхідно проводити визначення тесту із застосуванням агоністу гонадотропін-рилізинг гормону, рівні статевих гормонів та стадію фізичного розвитку (Tanner staging), щоб підтвердити досягнення бажаного результату. Визначення кісткового віку повинне проводитися кожні 6 – 12 місяців. Дозу необхідно збільшувати доти, доки не зупиниться прогресу вання захворювання (що буде видно з клінічних та лабораторних показників). Перша доза, при якій досягнуто бажаного результату, може вважатися підтримуючою для подальшого лікування. Однак існує недостатньо даних для корекції дози, коли пацієнти переходять у вищу вагову категорію, якщо вони почали лікування в дуже малому віці. Тому пацієнтам, у яких збільшилась маса тіла, рекомендується адекватна оцінка ефективності лікування.
Терапію потрібно припиняти у дівчат до настання 11 років, у хлопців до – 12 років.
Приготування суспензії для ін’єкцій Люкрин Депо у флаконі
Суспензію для ін'єкцій готують безпосередньо перед введенням.
Використовуючи шприц, що додається у наборі, наберіть 1 мл розчинника та введіть його у флакон з порошком ліофілізованим.
Добре струсіть до утворення однорідної білої суспензії.
Наберіть повний вміст кожного флакону у шприц (максимум 2 мл у шприці) та зробіть ін’єкцію одразу після приготування суспензії.
Приготування суспензії для ін’єкцій Люкрин Депо в попередньо-наповненому двокамерному шприці
Вкрутіть білий поршень в кінцеву пробку до тих пір, поки пробка не почне повертатися.
Тримайте шприц вертикально. Вивільніть розчинник, м’яко натискаючи на поршень (протягом 6 – 8 секунд) до тих пір, поки перша пробка не дійде до синьої лінії посередині циліндру шприца.
Тримайте шприц вертикально. Обережно повністю змішайте часточки до
утвореня однорідної білої суспензії.
Тримайте шприц вертикально. Вільною рукою потягніть кришечку голки
догори, не провертаючи її.
Просувайте поршень вперед, щоб видалити повітря з шприца.
Введіть повний вміст шприца внутрішньом’язово або підшкірно відразу після приготування суспензії. Суспензія осідає дуже швидко, тому її необхідно використати відразу після приготування.
Примітка. У пере ходнику голки буде видно кров у разі її аспірації під час ін’єкції.
Побічні реакції.
Побічні реакції представлені за органами та системами органів та по частоті виникнення: дуже часто: більше 10 %, часто: 1 % - 10 %, нечасто: 0,1 % - 1 %, поодинокі: 0,01 % - 0,1 %, рідкісні: менше 0,01 %.
Побічні реакції, про які повідомлялося при клінічних дослідженнях
Рак простати
У більшості пацієнтів підвищувались рівні тестостерону під час першого тижня, знижуючись до вихідного рівня або нижче до кінця другого тижня лікування.
Протягом перших декількох тижнів лікування можуть загостритися симптоми у пацієнтів з метастазами в хребет та/або з обструкцією сечовивідних шляхів або гематурією, які якщо прогресують, можуть привести до появи неврологічних симптомів, таких як тимчасова слабкість та/або парестезія нижніх кінцівок або погіршення симптомів з боку сечового тракту.
Наступні побічні реакції були зафіксовані під час клінічних досліджень і мали можливий або ймовірний зв’язок з препаратом.
Система органів Побічні реакції з частотою 5 % і більше Побічні реакції з частотою менше 5 %
Карді альні порушення набряки стенокардія, аритмія
Шлунково-кишкові розлади нудота/блювання анорексія, діарея
Ендокринні розлади зменшення розмірів яєчок, припливи/потіння, імпотенція (фізіологічні ефекти зниження рівня тестостерону) гінекомастія, знижене лібідо
Неврологічні розлади загальний біль парестезія, безсоння
Порушення з боку дихальної системи задишка кровохаркання
Порушення з боку опорно-рухової системи та сполучної тканини - осалгія, міалгія
Розлади з боку сечостатевої системи - дизурія, гематурія, біль у яєчках
Зміни з боку шкіри і підшкірної клітковини - дерматит, локальні реакції на шкірі, гіпертрихоз
Інші астенія діабет, грипоподібний синдром, збільшення маси тіла, відчуття клубка у горлі, гіперкальціємія, гіперурикемія
Ендометріоз
Рівні ест радіолу можуть підвищуватися протягом перших тижнів після першої ін’єкції, але потім знижуються до менопаузальних рівнів у хворих на ендометріоз/фіброміому матки. Транзиторне підвищення рівня ест радіолу може асоціюватися з тимчасовим загостренням симптомів.
Наступні побічні реакції були зафіксовані під час клінічних досліджень і мали можливий або ймовірний зв’язок з препаратом.
Система органів Побічні реакції з частотою 5 % та більше Побічні реакції з частотою менше 5 %
Карді альні порушення набряки підсилене серцебиття, синкопе, тахікардія
Шлунково-кишкові розлади нудота/блювання сухість у роті, спрага, зміни апетиту
Ендокринні розлади припливи/потіння, біль у молочних залозах, знижене лібідо (фізіологічні ефекти зниження рівня естрогену) андроген-подібні ефекти, акне, себорея, гірсутизм, зміни голосу -
Неврологічні розлади депресія/емоційна лабільність, головний біль, нейро-м’язові розлади, порушення сну/безсоння, нервозність (фізіологічні ефекти зниження рівня естрогену), запаморочення, загальний біль, парестезії занепокоєння, зміни особистості, порушення пам’яті, галюцинації
Порушення з боку опорно-рухової системи та сполучної тканини міалгія, артралгія (фізіологічні ефекти зниження рівня естрогену) -
Розлади з боку сечостатевої системи вагініт (фізіологічний ефект зниження рівня естрогену) дизурія, лактація
Зміни з боку шкіри и підшкірної клітковини шкірні реакції екхімози, алопеція, порушення росту волосся
Інші астенія, збільшення/втрата маси тіла офтальмологічні розлади, лімфаденопатія
Фіброміома матки
Наступні побічні реакції були зафіксовані під час клінічних досліджень і мали можливий або ймовірний зв’язок з препаратом.
Система органів Побічні реакції з частотою 5 % та більше Побічні реакції з частотою менше 5 %
Карді альні порушення набряки -
Шлунково-кишкові розлади нудота/блювання сухість у роті, діарея, запор, спрага, підвищення апетиту, метеоризм
Ендокринні розлади припливи/потіння (фізіологічні ефекти зниження рівня естрогену) знижене лібідо, біль у молочних залозах
Неврологічні розлади депресія/емоційна лабільність, головний біль (фізіологічні ефекти зниження рівня естрогену), безсоння, загальний біль запаморочення нервозність, парестезія
Порушення з боку опорно-рухової системи та сполучної тканини артралгія міалгія, підвищений тонус м’язів
Розлади з боку сечостатевої системи вагініт (фізіологічний ефект зниження рівня естрогену) -
Зміни з боку шкіри и підшкірної клітковини місцеві шкірні реакції зміна нігтів
Інші астенія збільшення/втрата маси тіла, розлади смакової чутливості, грипоподібний синдром, вагінальний запах
Рак молочної залози
Наступні побічні реакції були зафіксовані під час порівняльних клінічних досліджень і мали можливий зв’язок з препаратом та зустрічались з частотою 10% і більше:
Система органів Побічні реакції
Шлунково-кишкові розлади нудота, блювання, підвищення/зниження апетиту, втрата апетиту, діарея, запор
Ендокринні розлади припливи, відчуття жару, потіння
Неврологічні розлади головний біль, тупий головний біль, нервозність, зміни настрою, біль у спині, безсоння, запаморочення, депресія,
Порушення з боку опорно-рухової системи та сполучної тканини артралгія
Розлади з боку сечостатевої системи церві кальний біль, вагініт
Зміни з боку шкіри і підшкірної клітковини алопеція, втрата волосся, еритема
Інші зниження фізичної активності, загальна слабкість, збільшення або втрата маси тіла, лейкопенія, дерматит, біль або ущільнення в місці ін’єкції, симптоми застуди
Побічні реакції, що спостерігались у дітей при клінічних дослідженнях
Система органів Побічні реакції з частотою 2 % і більше Побічні реакції з частотою менше 2 %
Карді альні порушення вазодилатація брадикардія, гіпертензія, порушення периферичних судин, синкопе
Шлунково-кишкові розлади - нудота/блювання, дисфагія, гінгівіт, закреп, диспепсія, підвищений апетит
Порушення з боку дихальної системи - астма, носова кровотеча, риніт, синусит
Ендокринні розлади - прискорене статеве дозрівання, фемінізація, зоб
Порушення обміну речовин, метаболізму - периферичний набряк, збільшення маси тіла, уповільнення зростання
Неврологічні розлади загальний біль, емоційна лабільність, головний біль нервозність, сонливість, депресія, гіперкінезія
Порушення з боку опорно-рухової системи і сполучної тканини - артралгія, міалгія, міопатія, порушення функції суглобів
Розлади з боку сечостатевої системи вагініт, вагінальна кровотеча, білі гінекомастія, нетримання сечі, порушення шийки матки/новоутворення, дисменорея, порушення менструальної функції/ молочних залоз
Зміни з боку шкіри і підшкірної клітковини акне, себорея, реакції у місці введення, включаючи абсцес (більшість реакцій були легкого або середнього ступеня тяжкості), висип, включаючи еритему мультиформну алопеція, порушення росту волосся, нігтів, гірсутизм, лейкодерма, гіпертрофія шкіри, пурпура
Загальні порушення, лабораторні дослідження
- агравація вже існуючого новоутворення, зниження зору, алергічна реакція, запах тіла, лихоманка, грипоподібні симптоми, гіпертрофія, інфекційні захворювання, поява антинуклеарних антитіл, збільшення ШОЕ
Пост маркетингові дані (у всіх вікових групах)
Враховуючи неможливість точного підрахунку пацієнтів при пост маркетинговому застосуванні, побічні реакції надані без підрахунку їх частоти.
Наступні побічні реакції спостерігались при застосуванні цього або інших дозувань лейпроліду ацетату. Оскільки даний препарат має кілька показань для застосування у різних категорій пацієнтів, деякі побічні реакції можуть не стосуватися кожного окремого пацієнта. Для більшості побічних реакцій причинно-наслідковий зв’язок з препаратом не було встановлено.
Карді альні порушення: стенокардія, брадикардія, аритмія, хронічна серцева недостатність, зміни на електрокардіограмі (ЕКГ), підвищення/зниження артеріального тиску, аускультативні шуми, інфаркт міокарду, флебіт, емболія легеневої артерії, інсульт, синкопе, тахікардія, тромбози, транзиторні ішемічні атаки, варикозне розширення вен.
Шлунково-кишкові розлади: діарея або запор, сухість у роті, виразка дванадцяти палої кишки, гастроінтестинальна кровотеча, гастроінтестинальні порушення, порушення функції печінки, підвищення апетиту, зміни показників печінкових ферментів, нудота, виразка шлунка, поліпи прямої кишки, спрага, блювання.
Ендокринні розлади: діабет, збільшення щитоподібної залози, а також, як і при використанні інших препаратів даної групи, спостерігались дуже рідкі випадки крововиливів у гіпофіз після першого призначення у пацієнтів з аденомою гіпофіза.
Порушення з боку системи крові та лімфатичної системи: анемія, екхімози, лімфедема, збільшення протромбі нового та часткового тромбопластинового часу, тромбоцит опенія, лейкоцитоз, лейкопенія.
Порушення обміну речовин, метаболізму: підвищення рівня сечовини крові, гіперкальціємія та гіперкреатинемія, дегідратація, набряк, гіперліпідемія (збільшення загального холестерину, ліпопротеїнів низької щільності, три гліцеридів), гіперфосфатемія, гіпоглікемія, гіпопротеїнемія, гіпонатріємія, гіперурикемія, гіпербілірубінемія, поодинокі випадки анафілаксіі.
Порушення з боку опорно-рухової системи та сполучної тканини: анкілозуючий спондиліт, артралгія, міалгія, тазовий фіброз, перелом хребта, параліч, тендосиновіїт-подібні симптоми, осалгія.
Неврологічні розлади: занепокоєння, галюцинації, депресія, запаморочення, стан перед непритомністю, гіпоестезія, безсоння, летаргія, підвищення лібідо, порушення пам'яті, зміни настрою, нервозність, нейром'язові розлади, оніміння, парестезія, периферична нейропатія, порушення сну, порушення смакової чутливості, судоми. Дуже рідко відмічались випадки появи у хворих думки про самогубство та суїцид альні спроби.
Порушення з боку дихальної системи: кашель, задишка, носова кровотеча, фарингіт, плевральний випіт, шум тертя плеври, пневмонія, фіброзні утворення в легенях, інфільтрати в легенях, розлад дихання, застій у синусах.
Зміни з боку шкіри і підшкірної клітковини: карцинома шкіри/вуха, дерматит, сухість шкіри, свербіж, висип, підвищений/знижений ріст волосся, відчуття клубка у горлі, пігментація, пошкодження шкіри, кропив’янка. Реакції у місці введення, включаючи біль, запалення, стерильний абсцесс, ущільнення тканин, гематому.
Порушення з боку органа зору: порушення зору, амбліопія, затуманений зір, офтальмологічні порушення, сухість ока.
Порушення з боку органа слуху та вестибулярного апарату: порушення слуху, шум у вухах.
Розлади з боку сечостатевої системи: спазми у сечовому міхурі, біль у молочних залозах, чутливість молочних залоз, гінекомастія, гематурія, нетримання сечі, дисменорея, включаючи перерви та безперервні вагінальні кровотечі, набрякання/розлади функції пеніса, біль у простаті, атрофія яєчок, біль у яєчках, зменшення розміру яєчок, порушення сечовипускання (збільшення частоти, обструкція, імперативні позиви), інфекції сечостатевого тракту.
Загальні розлади: здуття живота, астенія, лихоманка, озноб, загальний біль, головний біль, інфекційні захворювання, симптоми запалення, реакції світлочутливості, набрякання в області скроневої кістки, жовтяниця.
Передозування.
Даних відносно передозування у людей немає. У дослідах на тваринах із застосуванням доз, що в 500 разів перевищують рекомендовані до застосування дози у людей, спостерігали диспное, підвищення активності та подразнення в місці ін’єкції. Клінічне підтвердження цих даних на теперішній час відсутнє. У клінічних дослідженнях при проведенні щоденних підшкірних ін'єкцій лейпролида ацетату в дозі 20 мг в день хворим з раком передміхурової залози протягом 2 років не спостерігалися побічні реакції, які б відрізнялися від реакцій хворих, яким вводили дозу в 1 мг в день.
Застосування у період вагітності або годування груддю.
Люкрин Депо не призначається вагітним жінкам або жінкам, які можуть завагітніти під час застосування препарату. При застосуванні у тестових дозах 0,00024, 0,0024 та 0,024 мг/кг у кролів на шостий день вагітності було зафіксоване дозозалежне збільшення частоти розвитку великих аномалій плода. Подібні дослідження у щурів не показали почастішання розвитку аномалій плода. Спостерігалось збільшення смертності та зниження маси тіла плода при застосуванні двох вказаних найвищих доз у кролів та найвищої дози у щурів. Ефект у вигляді зростання фетальної смертності є наслідком ураження на гормональному рівні, спричиненого даним препаратом. Є імовірність спонтанних абортів в разі застосування препарату під час вагітності.
Невідомо, як лейпролід накопи чується у грудному молоці, тому його рекомендується призначати з обережністю в період годування груддю.
Діти.
При застосуванні у дітей з центральним передчасним статевим дозріванням повинні застосовуватися такі критерії відбору:
Клінічний діагноз: “Центральне передчасне статеве дозрівання” (ідіопатичне або нейрогенне) з появою вторинних статевих ознак у дівчат раніше 8 років та у хлопців раніше 9 років.
Клінічний діагноз повинен бути підтверджений до початку терапії за допомогою тесту з застосуванням агоністу гонадотропін-рилізинг гормону, кістковий вік випереджує хронологічний на 1 рік.
Визначення маси тіла та зросту, рівнів статевих гормонів, рівнів гормонів наднирників для виключення вродженої гіперплазії наднирників, визначення рівня людського бета-хор іонічного гонадотропіну для виключення гонадотропін-секретуючої пухлини, УЗД-дослідження органів таза, яєчків, наднирників для виключення стероїд-секретуючої пухлини, комп’ютерна томографія голови для виключення внутрішньо черепної пухлини.
Під час ранньої фази лікування відбувається збільшення концентрації статевих стероїдних гормонів та гонадотропінів, що обумовлено природнім стимулюючим ефектом препарату, тому може спостерігатись збільшення клінічних проявів та симптомів.
Невідповідність режиму введення або дозування препарату може призвести до неадекватного контролю над пубертатним розвитком. Наслідками поганого контролю може бути повернення пубертатних ознак (менструальна функція, розвиток молочних залоз, збільшення яєчок). Рівень статевих гормонів в плазмі крові може підвищуватися або бути вищим за пре пубертатні рівні в разі невірно підібраної дози препарату. Коли визначено вірну підтримуючу дозу, гонадотропін та рівень статевих гормонів знижується до пре пубертатного рівня.
Інформація для батьків
До початку терапії препаратом Люкрин Депо батьки або опікуни повинні знати про важливість продовження терапії. Для успішної терапії необхідно суворе дотримання режиму введення 1 раз на 4 тижні.
Під час перших двох місяців терапії у дівчат можуть бути менструальні кровотечі та мазання. Якщо кровотечі продовжуються більше 2 місяців, повідомте лікаря.
Про будь-яке подразнення в місці введення або незвичайний симптом необхідно повідомляти лікаря.
У дітей з центральним передчасним статевим дозріванням при застосуванні лейпроліду ацетату у клінічних дослідженнях рівні гонадотропного гормону, тестостерону та ест радіолу знижуються до пре пубертатних рівнів відповідно до статі дитини. Це обумовлює нормальний фізичний та фізіологічний розвиток дитини. Природний статевий розвиток відбувається при поверненні рівня гонадотропних гормонів до пубертатного після відміни лейпроліду ацетату.
Такі фізіологічні ефекти були визначені у дітей з центральним передчасним статевим дозріванням при постійному застосуванні препарату:
Ріст скелету (помірне збільшення довжини тіла до передчасного закриття зон росту);
Репродуктивні органи повертаються до пре пубертатного стану;
Менструальна функція, якщо була, зникає.
Особливості застосування.
Рак передміхурової залози.
Протягом перших декількох тижнів лікування лейпроліду ацетатом можуть розвинутися симптоми, що минають, погіршення стану або виникають додаткові ознаки та симптоми основного захворювання. У деяких пацієнтів тимчасово може посилитися осалгія. Як і при застосуванні інших агоністів гонадотропін-рилізинг гормону, відмічались окремі випадки обструкції сечівника та здавлення спинного мозку, що може спричинити параліч з або без фатальних ускладнень. У хворих з підвищеним ризиком виникнення цих явищ слід розглянути питання щодо застосування лейпроліду ацетата у лікарській формі для щоденного застосування протягом перших двох тижнів для того, щоб було можливо припинити лікування у разі потреби.
Хворі з метастатичними пошкодженнями хребта та/або обструкцією сечовивідних шляхів повинні знаходитися під ретельним спостереженням протягом перших тижнів лікування.
Ендометріоз/фіброміома матки.
На початку курсу лікування спостерігається збільшення концентрації статевих стероїдних гормонів, що обумовлене фізіологічними проявами дії препарату. Деяке посилення симптоматики на початку терапії досить швидко минає при продовженні лікування адекватно підібраними дозами препарату. Повідомлялось про випадки тяжкої вагінальної кровотечі у пацієнток з підслизовою фіброміомою, що потребувала медичного або хірургічного втручання при продовженні терапії лейпроліду ацетатом.
Можливу вагітність бажано визначати перед початком застосування лейпролиду ацетату. Лейпроліду ацетат – не контрацептивний засіб. Для запобігання вагітності потрібно застосовувати негормональні методи контрацепції.
Мінеральна щільність кісткової тканини
При будь-якому гіпоестрогенному стані у жінок спостерігається зміна щільності кісткової тканини при денситометрії кісток. Оскільки втрата кісткової щільності супроводжує природну менопаузу, можна очікувати такий прояв і при медично-індукованому гіпоестрогенному стані (після закінчення 6 місячного курсу лікування лейпроліду ацетатом щільність кісткової тканини відновлюється).
Лабораторні дослідження
Відповідь на лікування лейпроліду ацетатом повинна контролю ватися визначенням рівня тестостерону та простат специфічного антигену у плазмі. У більшості пацієнтів рівень тестостерону підвищувався під час першого тижня лікування, знижуючись до нормального рівня або нижче до кінця другого тижня. Кастрацій ні рівні досягаються протягом 2 – 4 тижнів та підтримуються, доки пацієнт вчасно отримує ін’єкції.
Застосування Люкрину Депо спричиняє у жінок пригнічення функції гіпофізарно-гонадотропної системи. Після закінчення лікування функція відновлюється через 3 місяці. Діагностичні тести щодо функції гіпофіза або статевих залоз, які проводять під час лікування та протягом 3 місяців після його закінчення, можуть бути
неточними.
Здатність впливати на швидкість реакції при керуванні авто транспортом або роботі з іншими механізмами.
Немає відомостей про те, що застосування лейпроліду ацетату призводить до погіршення цієї здатності, проте слід враховувати імовірність побічних реакцій з боку нервової системи та органу зору.
Взаємодії з іншими лікарськими засобами та інші види взаємодій.
Не очікується взаємодій, оскільки лейпроліду ацетат розщеплюється за допомогою пептидази та має низьку спорідненість з протеїнами плазми.
Фармакологічні властивості.
Фармакодинаміка.
Лейпроліду ацетат – агоніст гонадотропін-рилізинг гормону, діє як інгібітор секреції гонадотропіну при постійному застосуванні в терапевтичних дозах. У дослідженнях на тваринах та людях було показано, що після першої стимуляції при постійному застосуванні лейпроліду ацетату відбувається супресія оваріального та тестикулярного стероїдогенезу. Ефект є оборотним при закінченні терапії.
Призначення лейпроліду ацетату інгібує ріст деяких гормонозалежних пухлин, та призводить до атрофії репродуктивних органів.
У людей при застосуванні лейпроліду ацетату відбувається початковий підйом рівнів лютеїнізуючого та фолікулостимулюючого гормонів, що призводить до транзиторного підйому рівнів тестостерону та дигідротестостерону у чоловіків та фолікуліну та ест радіолу у жінок в пре менопаузі.
Продовження застосування лейпроліду ацетату веде до зниження рівнів лютеїнізуючого та фолікулостимулюючого гормонів та статевих гормонів. У чоловіків рівні тестостерону знижується до кастрацій них або пре пубертатних. У жінок в пре менопаузі рівні естрогенів знижуються до пост менопаузальних. Зміни рівнів гормонів відбуваються протягом місяця від початку терапії в рекомендованих дозах.
Фармакокінетика.
Лейпроліду ацетат неактивний при пероральному застосуванні. Біодоступність препарату при підшкірному введенні відповідає такій при внутрішньом’язовому введенні. Абсолютна біодоступність із дози 7,5 мг становить 90 %.
Абсорбція. Після внутрішньом’язової або підшкірної ін’єкції Люкрину Депо 3,75 мг та 7,5 мг пацієнтам з раком передміхурової залози спостерігались плазмові концентрації лейпроліду ацетату на кінець першого місяця 0,7 нг/мл та 1,0 нг/мл відповідно. Накопичення препарату не спостерігається. Були визначені плазмові рівні лейпроліду ацетату при застосуванні дози 3,75 мг у 11 пацієнток з раком молочної залози в пременопаузальному періоді через 12 тижнів. Рівень препарату в плазмі крові був більше 0,1 нг/мл через 4 тижні та залишався стабільним при повторних ін’єкціях (на 8 – 12 тижнях). Тенденції до накопичення не спостерігалось.
Розподіл. Середній рівноважний об'єм розподілу після внутрішньо венного введення здоровим добровольцям становить 27 л. In vitro зв'язок з білками плазми становить 43 – 49 %.
Метаболізм. Після внутрішньо венного введення здоровим добровольцям 1 мг лейпроліду ацетату системний кліренс становив 7,6 л з кінцевим напів виведенням приблизно 3 години. Досліди на тваринах показали, що С14 мічений лейпроліду ацетат підлягає метаболічній деградації, головним чином, до більш коротких неактивних пептидів - пентапептиду (метаболіт І), три пептиду (метаболіти II та III) та дипептиду (метаболіт IV). Концентрація основного метаболіту М-І досягає максимального рівня протягом 2 – 6 годин і становить 6 % від максимального рівня лейпроліду. Через тиждень після ін'єкції середня концентрація М-І у плазмі становить 20 % від середньої концентрації лейпроліду.
Виведення. Через 27 днів після призначення лейпроліду ацетату 3,75 мг трьом пацієнтам у сечі визначалось менше 5 % дози батьківської речовини та метаболіту М-І.
Фармакокінетика у пацієнтів з нирковою та печінковою недостатністю не визначалась.
До клінічні дослідження.
Було проведено дворічне дослідження канцерогенезу на мишах та кролях. У кролів при призначенні препарату підшкірно у щоденній дозі 0,6 – 4 мг/кг було відмічено дозозалежне збільшення частоти виникнення доброякісної гіперплазії гіпофізу та доброякісної аденоми гіпофізу. Відмічали значне, але недозозалежне почастішання виникнення аденоми з клітин острівця Лангерганса у самиць та аденоми з інтерстиційних клітин яєчок у самців. У мишей у дозі 60 мг/кг протягом 2 років не спостерігалось ніяких пухлин або гіпофізарних аномалій, викликаних лейпроліду ацетатом.
Вивчення мутагенезу проводилось на бактеріях та на ссавцях. Ці дослідження не виявили доказів мутагенного потенціалу лейпроліду ацетату. Клінічні та фармакологічні дослідження з лейпроліду ацетатом та схожими аналогами у дорослих показали повну оборотність супресії фертильності при відміні препарату після тривалого застосування до 24 тижнів.
Фармацевтичні характеристики.
Основні фізико-хімічні властивості: білий порошок; після приготування: біла суспензія, при відстоюванні утворюється білий осад, що легко ре суспендується при струшуванні.
Несумісність. Не застосовувати для розведення розчинники окрім того, що надається в наборі.
Термін придатності. 3 роки.
Умови зберігання. Зберігати у недоступному для дітей місці при кімнатній температурі
(15 – 25 ° С).
Упаковка.
Люкрин Депо у флаконі
1 набор в блістер ній упаковці, по 1 або 43 набори упаковані в картонну коробку.
Набор містить: 1 флакон з порошком ліофілізованим, 1 ампула з розчинником (2 мл), 2 стерильні голки, 1 одноразовий шприц, 1 серветка, просякнута 70 % ізопропіловим спиртом.
Люкрин Депо у попередньо-наповненому двокамерному шприці
1 набор в пластиковому контейнері, упакований в картонну коробку.
Набор містить: 1 попередньо-наповнений двокамерний шприц з порошком ліофілізованим та розчинником (1 мл), 1 поршень для шприца, 1 серветка, просякнута 70 % ізопропіловим спиртом.
Категорія відпуску. За рецептом.
Виробник. Такеда Фармасьютікал Компані Лтд, Японія; Абботт Лабораторіз С. А. Іспанія/ Takeda Pharmaceutical Company Ltd, Japan; Abbott Laboratories S.A. Spain.
Місцезнаходження. 17-85 Юсохонмачі 2-Хоме, Йодогава-Ку, Осака 532-8686, Японія; Авда де Бургос, 91, 28050, Мадрид/ 17-85 Jusohonmachi 2-Сhome, Yodogawa-Кu, Osaka 532-8686, Japan; Avda de Burgos, 91, 28050 Madrid.
| Кількість переглядів: |