Ліки від а до я -
Хвороби -
Калькулятор калорій -
Магнітні бурі -
Дієти -
Очищення організму -
Схуднення -
Молочниця
Геморой -
Лікування -
Косметологія -
Поради -
Інсульт -
Інфаркт -
Діабет -
Варикоз -
Вправи -
Covid-19
Ліки та препарати
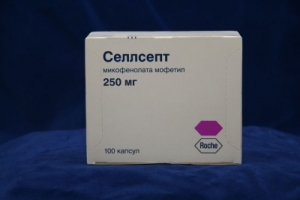
Селлсепт
Рош С. п. А, Італія
Інструкція
Склад:
діюча речовина: mycophenolic acid;
1 капсула містить мофетилу мікофенолату 250 мг;
допоміжні речовини: крохмаль кукурудзяний преже латинізований, кроскармелоза натрію, повідон (К 90), магнію стеарат; капсула: желатин, натрію лаурилсульфат, натрію карбоксим етилцелюлоза, кремнію діоксид, титану діоксид, індигокармін, заліза оксид червоний, заліза оксид жовтий.
Лікарська форма. Капсули.
Фармакотерапевтична група. Селективні імуносупресивні препарати. Кислота мікофенолова.
Код АТС L04AA06.
Клінічні характеристики.
Показання.
Профілактика гострого відторгнення органа та лікування рефрактерного до терапії відторгнення органа у хворих після алогенної трансплантації нирки.
Профілактика гострого відторгнення органа та поліпшення виживаності трансплантату і виживаності пацієнтів після алогенної трансплантації серця.
Профілактика гострого відторгнення органа у хворих після алогенної трансплантації печінки.
Селлсепт призначають у вигляді комбінованої терапії з циклоспорином і кортикостероїдами.
Протипоказання.
Гіпер чутливість до мофетилу мікофенолату, мікофенольної кислоти та інших компонентів препарату. Вагітність.
Селлсепт також протипоказаний пацієнтам з гіперчутливістю до полісорбату 80.
Спосіб застосування та дози.
Профілактика відторгнення нирки.
Хворим із нирковими трансплантатами рекомендується прийом по 1 г двічі на добу (добова доза 2 г). У клінічних дослідженнях також застосовувалася доза в 1,5 г двічі на добу (добова доза 3 г), що була безпечною і ефективною, проте її переваги щодо ефективності у хворих після пересадки нирки не встановлені. У хворих, котрі застосовували 2 г Селлсепту на добу, профіль безпеки був у цілому краще, ніж у тих, які застосовували добову дозу 3 г.
Лікування першого чи рефрактерного відторгнення нирки.
Як для початкового лікування рефрактерного до терапії іншими імуносуп ресорами гострого клітинно-опосердкованого відторгнення, так і для підтримуючої терапії хворим рекомендується добова доза в 3 г (1,5 г 2 рази на добу).
Профілактика відторгнення серця.
Рекомендований режим дозування – по 1,5 г 2 рази на добу.
Профілактика відторгнення печінки.
Рекомендований режим дозування – по 1,5 г 2 рази на добу.
Після пересадки нирки, серця або печінки першу дозу Селлсепту слід приймати якомога швидше.
Селлсепт повинен призначатися одночасно зі стандартною терапією циклоспорином і кортикостероїдами.
Побічні реакції.
Дані клінічних досліджень
Профіль побічних дій, пов'язаних із застосуванням імуносупресорів, часто важко встановити через наявність основного захворювання та одночасного застосування багатьох інших лікарських засобів. Основними побічними реакціями, пов'язаними із застосуванням Селлсепту в комбінації з циклоспорином і кортикостероїдами, є діарея, лейкопенія, сепсис і блювання; існують також дані про підвищення частоти опортуністичних інфекцій. Профіль безпеки Селлсепту при лікуванні рефрактерного відторгнення нирки був аналогічний такому при профілактиці відторгнення нирки при використанні препарату в дозі 3 г на добу. Діарея і лейкопенія з наступною анемією, нудота, блювання, диспепсія, біль у животі та сепсис були переважними побічними реакціями, що зустрічалися у хворих, які приймали Селлсепт частіше, ніж у хворих, котрі застосовували внутрішньо венно кортикостероїди.
Злоякісні новоутворення.
У 0,4 – 1 % хворих після пересадки нирки, серця або печінки, за якими проводили спостереження не менше року і лікувались мофетилом мікофенолатом (в дозі 2 чи 3 г на добу) в комбінації з іншими імунодепресантами розвивались лімфопроліферативні захворювання або лімфоми. Карцинома шкіри (за винятком меланоми) спостерігалась у 1,6 – 4,2 % хворих, злоякісні новоутворення інших типів – у 0,7 – 2,1 % хворих. Трирічні дані щодо безпечності у пацієнтів після пересадки нирки або серця не виявили будь-яких неочікуваних змін за частотою злоякісних новоутворень порівняно з показниками за рік. При лікуванні рефрактерного відторгнення нирки частота лімфом при середньому періоді спостереження до 42 місяців становила 3,9 %.
Ризик опортуністичних інфекцій був підвищений у всіх пацієнтів і зростав зі збільшенням сумарної дози імунодепресантів. При призначенні мофетилу мікофенолат (2 чи 3 г на добу) в комбінації з іншими імунодепресантами хворим, за якими проводили спостереження протягом року після пересадки нирки (у дозі 2 г на добу), серця та печінки, найчастішими інфекціями були кандидоз шкіри і слизових оболонок, цитомегаловірусна віремія/цитомегаловірусний синдром (13,5 %), інфекція, викликана вірусом простого герпесу. У хворих літнього віку (≥ 65 років) при лікуванні Селлсептом у рамках комбінованої терапії ризик деяких інфекцій (включаючи тканинні інвазивні форми маніфестної цитомегаловірусної інфекції), а також, шлунково-кишкових кровотеч і набряку легень вище, ніж у пацієнтів більш молодшого віку.
Побічні ефекти, що спостерігалися у ≥ 10 % та у 3 – 10 % хворих, які лікувалися Селлсептом в комбінації з циклоспорином та кортикостероїдами після пересадки нирки, серця та печінки.
Організм у цілому (≥10 %): астенія, гарячка, головний біль, інфекції, болі (у животі, попереку, грудній клітці), периферичні набряки, сепсис, асцит, здуття живота, грижі, перитоніт, гикавка.
3 – 10 %: кісти (у тому числі лімфоцеле й гідроцеле), набряки обличчя, грипоподібний синдром, кровотечі, грижі, болі в області таза, целюліт, біль у шиї, блідість шкірних покривів.
Система крові й лімфатична система (≥10 %): анемія (у тому числі гіпохромна), лейкоцитоз, лейкопенія, тромбоцит опенія, екхімози.
3 – 10 %: екхімози, збільшення протромбі нового й тромбопластинового часу, панцитопенія.
Сечостатева система ≥10 %: гематурія, некроз ниркових канальців, інфекції сечовивідних шляхів, порушення функції нирок, олігурія.
3 – 10 %: альбумінурія, дизурія, гідронефроз, імпотенція, пієлонефрит, часте сечовипускання, гематурія, ніктурія, ниркова недостатність, нетримання й затримка сечі; гостра ниркова недостатність, набряк мошонки.
Серцево-судинна система ≥10 %: артеріальна гіпертензія, аритмія, брадикардія, серцева недостатність, артеріальна гіпотензія, перикардіальний випіт.
3 – 10 %: стенокардія, артеріальна гіпотензія, у тому числі ортостатична, тахікардія, брадикардія, тромбоз, втрата свідомості, вазодилатація; аритмії (суправентрикулярні й шлуночкові екстрасистоли, мерехтіння й тріпотіння передсердь, суправентрикулярні й шлуночкові тахікардії), зупинка серця, застійна серцева недостатність, легенева гіпертензія, вазоспазм, підвищення венозного тиску.
Обмін речовин (≥10 %): ацидоз (метаболічний або респіраторний), збільшення маси тіла, гіперволемія; порушення загоєння ран.
3 – 10 %: після трансплантації нирки: ацидоз (метаболічний або респіраторний), збільшення маси тіла, дегідратація, гіперволемія, подагра, гіповолемія, гіпоксія, спрага, схуднення, алкалоз.
Лабораторні показники (≥10 %): гіперглікемія, гіперкаліємія, гіпокаліємія, гіпофосфатемія; гіпербілірубінемія, підвищення залишкового азоту, підвищення креатині ну, підвищення активності ферментів ЛДГ, АСТ, АЛТ у сироватці крові, гіперхолестеринемія, гіперліпідемія, гіперурикемія, гіпомагніємія, гіпонатріємія, гіпокальціємія, гіпопротеїнемія.
3 – 10 %: підвищення активності лужної фосфатази, гамма-глютамілтранспептидази, ЛДГ, АСТ і АЛТ у сироватці крові, підвищення креатині ну сироватки крові, гіперкальціємія, гіперліпідемія, гіпокальціємія, гіпоглікемія, гіпопротеїнемія, гіперурикемія, гіпохлоремія, гіпофосфатемія; гіпонатріємія.
Шлунково-кишковий тракт >10 %: диспепсія, блювання, запор, діарея, кандидоз ротової порожнини, холангіт, холестатичнина жовтуха, гепатит, анорексія.
3 – 10 %: дисфагія, гінгівіт, гіперплазія ясен, стоматит, езофагит, гастрит, гастроентерит, шлунково-кишкові кровотечі, виразка шлунка, кишкова непрохідність, мелена, ураження прямої кишки, кандидоз шлунково-кишкового тракту.
Органи дихання ≥10 %: посилення кашлю, задишка, фарингіт, пневмонія, бронхіт; бронхіальна астма, плевральний випіт, риніт, синусит; ателектаз.
3 – 10 %: астма, плевральний випіт, набряк легень, риніт, синусит, апное, ателектаз, бронхіт, носові кровотечі, кровохаркання, новоутворення, пневмоторакс, набряк легень, посилення виділення мокротиння, зміна голосу, гіпервентиляція, кандидоз дихальних шляхів, риніт.
Шкіра і її придатки ≥10 %: акне, простий герпес, оперізуючий лишай, висип, свербіж, підвищена пітливість.
3 – 10 %: випадіння волосся, доброякісні новоутворення шкіри, грибковий дерматит, простий герпес, оперізувальний лишай, гірсутизм, свербіж, рак шкіри, гіпертрофія шкіри, підвищена пітливість, шкірні виразки, висип, підвищена пітливість, акне, крововиливи, везикулобульозні висипи.
Нервова система ≥10 %: запаморочення, безсоння, тремор; психомоторне збудження, тривога, сплутаність свідомості, депресія, гіпертонус, парестезії, сонливість, тремор.
3 – 10 %: психомоторне збудження, депресія, гіпертонус скелетної мускулатури, парестезії, сонливість; судоми, емоційна лабільність, галюцинації, нейропатія, запаморочення; делірій, сухість у роті, нейропатія, психоз, порушення мислення.
Кістково-м'язова система ≥10 %: судоми в ногах, біль у м'язах, м'язова слабкість.
3 – 10 %: болі в суглобах, судоми в ногах, болі в м'язах, м'язова слабкість, остеопороз.
Органи відчуття ≥10 %: амбліопія.
3 – 10 %: амбліопія, катаракта, кон’юнктивіт, порушення зору, глухота, біль у вухах, крововилив в око, вестибулярні запаморочення.
Ендокринна система 3–10 %: цукровий діабет, захворювання пара щитовидних залоз, синдром Кушинга, гіпотиреоз.
При профілактиці відторгнення ниркового трансплантату профіль безпеки ММФ в добовій дозі 2 г був дещо кращим, ніж у добовій дозі 3 г.
Після реєстраційне застосування препарату
Органи травлення: коліт (іноді цитомегаловірусної етіології), панкреатит, окремі випадки атрофії кишкових ворсин.
Імунна система: окремі випадки тяжких, що загрожують життю інфекцій (менінгіту, інфекційного ендокардиту), підвищення частоти деяких інфекцій типу туберкульозу й атипових форм мікобактеріальних інфекцій.
У пацієнтів, яких лікували мофетилом мікофенолатом, були зареєстровані випадки прогресивної мультифокальної лейкоенцефалопатії, інколи з летальним кінцем. Ці пацієнти мали фактори ризику розвитку прогресивної мультифокальної лейкоенцефалопатії, включаючи лікування імуносупресантами та погіршення функції імунної системи.
Вроджені вади розвитку: вроджені вади розвитку, включаючи вади розвитку вуха були зареєстровані у новонароджених, матері яких застосовували мофетилу мікофенолат з іншими імуносупресивними препаратами під час вагітності.
Були зареєстровані випадки червоно клітинної аплазії у пацієнтів, яким проводилось лікування Селлсептом у комбінації з іншими імуносупресантами.
Інші побічні реакції, виявлені в після реєстраційному періоді застосування препарату подібні до тих, що спостерігались при клінічних дослідженнях.
Передозування.
Дані про передозування мофетилу мікофенолату були отримані в клінічних дослідженнях та при після реєстраційному застосуванні. Небажані реакції, що виникли при передозуванні, співпадали з відомим профілем безпеки препарату. Очікується, що передозування мофетилом мікофенолатом може призвести до імуносупресії (а в результаті цього – до підвищення чутливості до інфекцій) та пригнічення кісткового мозку. У випадку розвитку нейтропенії застосування Селлсепту слід припинити або знизити дозу препарату.
Мофетилу мікофенолат не можна видалити з організму методом гемодіалізу, однак при високих концентраціях глюкороніду 2-морфолінового ефіру мікофенолової кислоти у плазмі (>100 мкг/моль), невеликі його кількості все-таки виводяться. Препарати, що зв'язують жовчні кислоти, наприклад, холестирамін, можуть сприяти виведенню 2-морфолінового ефіру мікофенолової кислоти з організму, збільшуючи його екскрецію.
Застосування у період вагітності або годування груддю.
Препарат категорії D. Існує підвищений ризик мимовільного викидня в першому триместрі вагітності, а також підвищений ризик вроджених пороків розвитку, включаючи аномалії розвитку вуха, вовча паща, заяча губа, дистальних відділів кінцівок, аномалії серця, стравоходу та нирок.
Пацієнтка, що планує завагітніти, не повинна застосовувати Селлсепт доти, доки ефективні інші імуносупресивні препарати. Якщо пацієнтка застосовує препарат при плануванні вагітності або при виникненні вагітності, то вона повинна бути проінформована про потенційний шкоду для плода. ММФ може бути призначений лікарем лише у виняткових випадках, коли потенційна користь для матері перевищує можливий ризик для плода.
Терапію ММФ не слід починати доти, доки не отриманий негативний результат обстеження на вагітність при застосуванні методу аналіза сироватки чи сечі з чутливістю не менше 25 мМО/мл.
До початку терапії Селлсептом, у ході лікування і протягом 6 тижнів після його закінчення обов'язковим є використання ефективних методів контрацепції, навіть якщо в анамнезі жінки зазначена безплідність (за винятком перенесеної гістеректомії). Якщо утримання від статевого життя не можливе, необхідно використовувати два надійних методи контрацепції одночасно. Пацієнтки повинні бути проінформовані, що Селлсепт може знижувати рівень гормонів при пероральному прийомі контрацептивів та може знижувати ефективність цих протизаплідних засобів.
Не відомо, чи виділяється Селлсепт із жіночим молоком. Оскільки з жіночим молоком екскретуються багато препаратів, а також у зв'язку з можливістю серйозних побічних реакцій на мофетилу мікофенолат у немовлят, питання про продовження годування груддю або прийомом препарату вирішує лікар з урахуванням важливості лікування для матері.
Діти. Безпечність та ефективність препарату для хворих дитячого віку не встановлена. Фармакокінетичні дані щодо дітей, які перенесли трансплантацію нирки, досить обмежені, а щодо дітей після трансплантації серця або печінки відсутні.
Особливі заходи безпеки.
Оскільки мофетилу мікофенолат в експерименті на щурах і кролях виявив тератогенну дію, капсули Селлсепту не слід відкривати або розламувати. Необхідно уникати вдихання порошку, що міститься в капсулах Селлсепту, або його прямого потрапляння на шкіру або слизові оболонки. Якщо це відбулося, потрібно ретельно промити уражену ділянку водою з милом, а очі - лише водою.
Особливості застосування.
При нейтропенії (абсолютне число нейтрофілів < 1300 в 1 мкл) необхідно перервати лікування Селлсептом або зменшити його дозу і ретельно спостерігати за станом пацієнта.
У хворих із тяжкою хронічною нирковою недостатністю (швидкість клуб очкової фільтрації менш ніж 25 моль/хв/1,73 м2) поза найближчим пост трансплантаційним періодом або після терапії з приводу гострого або рефрактерного відторгнення варто уникати доз вище 2 г на добу. За цими хворими потрібно ретельно спостерігати.
Дані про ефективність препарату для пацієнтів з тяжкою нирковою недостатністю, які перенесли пересадку серця або печінки, відсутні.
Корекція дози хворим із затримкою функції ниркового трансплантата не потрібна.
Хворим, котрі перенесли трансплантації нирки і печінки з тяжкими ураженнями, корекція дози не потрібна. Дані про ефективність препарату для пацієнтів з тяжкими ураженнями печінки, які перенесли трансплантації серця, відсутні.
Для хворих літнього віку (≥ 65 років), які перенесли пересадку нирки, рекомендується доза 1 г 2 рази на добу, а після пересадки серця або печінки – 1,5 г 2 рази на добу.
Діти: безпека і ефективність препарату у хворих дитячого віку не встановлені. Фармакокінетичні дані, отримані у дітей, яким трансплантовано нирку обмежені, а у дітей після пересадки серця або печінки – відсутні.
Як і на фоні комбінованої імуносупресії взагалі, при призначенні мофетилу мікофенолату як компонента імуносупресивної схеми є підвищений ризик розвитку лімфом і інших злоякісних новоутворень, особливо шкіри (див. Побічні реакції). Цей ризик пов'язаний не із застосуванням будь-якого препарату як такого, а з інтенсивністю й тривалістю імуносупресії.
Хворим із підвищеним ризиком раку шкіри з метою обмежити вплив сонячних і ультрафіолетових променів слід носити відповідний закритий одяг й використовувати сонцезахисні креми з високим значенням захисного фактора.
Хворі, які застосовують мофетилу мікофенолат, повинні бути проінформовані про необхідність відразу ж повідомляти лікаря про будь-які ознаки інфекції, кровоточивості, кровотеч або інших ознаках пригнічення кісткового мозку. Надмірне пригнічення імунної системи може також підвищити чутливість до інфекцій, в тому числі до опортуністичних, сепсису та інших інфекцій із летальним наслідком. Під час лікування мофетилом мікофенолатом вакцинація може бути менш ефективною, необхідно уникати живих ослаблених вакцин. Можна проводити вакцинацію проти грипу у відповідності до національних рекомендацій.
Так як застосування мофетилу мікофенолату може супроводжуватись побічними реакціями з боку шлунково-кишкового тракту, необхідно з обережністю призначати препарат пацієнтам з захворюваннями шлунково-кишкового тракту у стадії загострення.
Мофетилу мікофенолат є інгібітором інозинмоно фосфатдегідрогенази, тому не слід призначити його пацієнтам із рідкісним генетично обумовленим спадковим дефіцитом гіпоксантингуанінфосфорибозилтрансфер ази (синдроми Леша-Найєна і Келлі-Зигміллера). Мофетилу мікофенолат не рекомендується призначати одночасно з азатіоприном, так як обидва препарати пригнічують кістковий мозок та їх одночасне застосування не вивчалось.
Необхідно дотримуватись обережності при одночасному прийомі мофетилу мікофенолату з препаратами, що впливають на печінково-кишкову циркуляцію, так як вони можуть знизити ефективність мофетилу мікофенолату.
Лабораторний контроль: при лікуванні мофетилом мікофенолатом необхідно визначати розгорнуту формулу крові протягом першого місяця – щотижнево, протягом другого і третього місяців лікування – два рази на місяць, а потім протягом першого року – щомісячно. Нейтропенія може бути пов’язана як із терапією мофетилом мікофенолатом, так і з застосуванням інших лікарських засобів, із вірусними інфекціями або поєднання цих факторів. При нейтропенії (абсолютна кількість нейтрофілів < 1300 в 1 мкл) необхідно перервати лікування Селлсептом або зменшити його дозу і ретельно спостерігати за станом пацієнта.
У пацієнтів, яких лікували мофетилом мікофенолатом, були зареєстровані випадки прогресивної мультифокальної лейкоенцефалопатії, інколи з летальним кінцем. Ці пацієнти взагалі мали фактори ризику розвитку прогресивної мультифокальної лейкоенцефалопатії, включаючи лікування імуносупресантами та погіршення функції імунної системи.
При виникненні неврологічної симптоматики у пацієнтів, які отримують імуносупресивну терапію, слід проводити диференційну діагностику, в тому числі з прогресивною мультифокальною лейкоенцефалопатією. За наявності клінічних показань слід призначити консультацію невропатолога.
Були зареєстровані випадки червоно клітинної аплазії у пацієнтів, яким проводилось лікування Селлсептом у комбінації з іншими імуносупресантами. Механізм виникнення червоно клітинної аплазії при застосуванні мофетил мікофенолатом невідомий. Вплив інших імуносупресантів в їх комбінації при імуносупресивній терапії також невідомий. В деяких випадках червоно клітинна аплазія була оборотною при зниженні дози або припиненні лікування Селлсептом. У пацієнтів із трансплантатом зменшення імуносупресії може бути небезпечним для трансплантату.
Здатність впливати на швидкість реакції при керуванні авто транспортом або іншими механізмами.
Препарат не впливає на швидкість реакції при керуванні транспортними засобами та роботі з машинами і складними механізмами.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Ацикловір. При призначенні мофетилу мікофенолату разом з ацикловіром спостерігалися більш високі концентрації глюкороніду 2-морфолінового ефіру мікофенолової кислоти та ацикловіру в плазмі, ніж при призначенні кожного препарату окремо. Оскільки плазмові концентрації глюкороніду 2-морфолінового ефіру мікофенолової кислоти, як і ацикловіру, підвищуються при нирковій недостатності, є ймовірність, що ці два препарати конкурують відносно канальцевої секреції, що може спричинити подальше підвищення концентрації обох лікарських препаратів.
Антациди, що містять гідроокис магнію та алюмінію: при прийомі разом з антацидами всмоктування мофетилу мікофенолату зменшується.
Холестирамін: після призначення разової дози в 1,5 г мофетилу мікофенолату здоровим добровольцям, які попередньо застосовували по 4 г холестираміну 3 рази на добу протягом 4 днів, спостерігалося зменшення AUCМФК на 40 %. Необхідно бути обережним при одночасному призначенні мофетилу мікофенолату і препаратів, що впливають на печінково-кишкову рециркуляцію.
Циклоспорин А: мофетилу мікофенолат не впливає на фармакокінетику циклоспорину А. При одночасному застосуванні вплив мікофенольної кислоти знижується на 30 – 50 %.
Ганцикловір: за результатами дослідження з разовим пероральним прийомом рекомендованих доз мофетилу мікофенолату і внутрішньо венним введенням ганцикловіру, з урахуванням відомого впливу ниркової недостатності на фармакокінетику мофетилу мікофенолату і ганцикловіру, можна припустити, що одночасне застосування цих препаратів (що конкурують у процесі канальцевої секреції) спричинить підвищення концентрацій глюкороніду 2-морфолінового ефіру мікофенолової кислоти і ганцикловіру. Істотної зміни фармакокінетики 2-морфоліноетилового ефіру мікофенолової кислоти не очікується, тому коригувати дозу мофетилу мікофенолату не потрібно. Якщо мофетилу микофенолат і ганцикловір призначають хворим із нирковою недостатністю, необхідно дотримуватися рекомендованого для ганцикловіру режиму дозування і ретельно спостерігати за хворими.
Пероральні контрацептиви: немає точних даних, чи впливає Селлсепт на пригнічення овуляції пероральними контрацептивами, проте під час лікування Селлсептом додатково з пероральними протизаплідними засобами слід застосовувати інші методи контрацепції.
Триметоприм/сульфаметоксазол, норфлоксацин, метронідазол: не впливають на біодоступність
2-морфоліноетилового ефіру мікофенолової кислоти при призначенні з одним із антибактеріальних препаратів. Але одночасне застосування Селлсепту в комбінації з норфлоксацином та метронідазолом знижує AUC 0-48 МФК на 30 % після одноразового застосування Селлсепту.
Такролімус: при одночасному застосуванні не виявлено впливу на AUC та Смакс МФК у пацієнтів після пересадки печінки та нирок. У пацієнтів після трансплантації нирок приймання Селлсепту не впливало на концентрацію такролімусу. У хворих із стабільним печінковим трансплантатом AUC такролімусу після багаторазового застосування ММФ у дозі 1,5 г двічі на добу зростала приблизно на 20 %.
Рифампіцин: після коригування дози відмічено зниження впливу мікофенольної кислоти та 70 %.
(AUC 0-12) у пацієнтів після одночасної трансплантації серця та легень, рекомендується контроль впливу МФК та коригування дози Селлсепту для підтримання клінічного ефекту при сумісному застосуванні.
Інші взаємодії: блокатори канальцієвої секреції (пробенецид) підвищують концентрацію глюкороніду 2-морфолінового ефіру мікофенолової кислоти. Севеламер та інші фосфатзв’язуючі препарати, що не містять кальцію, повинні призначатися через 2 години після приймання Селлсепту для зменшення впливу на всмоктування МФК.
Живі вакцини: не повинні вводитися пацієнтам у стані імунодепресії. Антитіло утворення у відповідь на інші вакцини може бути знижено.
Взаємодія Селлсепту з ципрофлоксацином та амоксациліном з клавулоновою кислотою.
Протягом декількох днів відразу після перорального застосування ципрофлокса цину чи амоксациліну з клавулоновою кислотою у пацієнтів з трансплантованою ниркою було повідомлено про зниження предозової (мінімальної) концентрації мікофенольної кислоти на 54 %. З продовженням антибіотико терапії даний ефект мав тенденцію до зменшення та зникав після припинення лікування антибіотиками.
Зміни предозового рівня мікофенольної кислоти не можуть точно свідчити про зміни загальної експозиції МФК, тому клінічне значення цих спостережень невідоме.
Фармакологічні властивості.
Фармакодинаміка. Мофетилу мікофенолат – це 2-морфоліноетиловий ефір мікофенолової кислоти (МФК). 2-морфоліноетиловий ефіру мікофенолової кислоти – потужний селективний неконкурентний і оборотний інгібітор інозинмоно фосфатдегідрогенази (ІМФДГ), що пригнічує синтез гуанозинових нуклеотидів de novo. Механізм, шляхом якого 2-морфоліноетиловий ефір мікофенолової кислоти пригнічує ферментну активність інозинмоно фосфатдегідрогенази пов'язаний із тим, що 2-морфоліноетиловий ефір мікофенолової кислоти структурно імітує як кофактор нікотинаміддинуклеотидфосфат, так і каталізуючу молекулу води. Це перешкоджає окисненню інозинмоно фосфату у ксантозо-5-моно фосфат – дуже важливий етап біосинтезу гуанозинових нуклеотидів de novo. 2-морфоліноетиловий ефір мікофенолової кислоти має більш виражену цитостатичну дію на лімфоцити, ніж на інші клітини, оскільки проліферація Т- і В-лімфоцитів сильно залежить від синтезу пуринів de novo, у той час як клітини інших типів можуть переходити на обхідні шляхи метаболізму.
Для профілактики відторгнення після пересадки нирки, серця та печінки, а також для лікування рефрактерного відторгнення пересадженої нирки мофетилу мікофенолат призначають в комбінації з антитимоцитарним глобуліном, ортоклоном мишачих моноклональних антитіл, циклоспорином та кортикостероїдами.
При трансплантації нирки застосування комбінації мофетилу мікофенолату з кортикостероїдами та циклоспорином знижує частоту неефективності лікування в перші 6 місяців після трансплантації та гістологічно доведеного відторгнення під час терапії, в дозі 2 г/добу – знижує кумулятивну частоту загибелі трансплантата та летальність через 12 місяців після трансплантації нирки, але при терапії засобом в дозі 3 г/добу збільшує частоту передчасного вибування із дослідження через будь-яку причину.
За частотою гістологічно доведеного відторгнення, летальності та повторних трансплантацій при пересадці серця мофетилу мікофенолат випереджає азатіоприн. Мофетилу мікофенолат в комбінації з кортикостероїдами та циклоспорином більш ефективно, ніж азатіоприн попереджує гостре відторгнення та забезпечує подібне виживання з азатіоприном у хворих з первинною пересадкою печінки. Лікування мофетил мікофенолатом знижує частоту загибелі трансплантата або летальних наслідків через 6 місяців після початку терапії на 45 % (р = 0,062) у пацієнтів, які перенесли пересадку нирки, з рефрактерним до терапії, гострим, клітинно-опосередкованим відторгненням трансплантата.
Фармакокінетика.
Фармакокінетичні характеристики мофетилу мікофенолат вивчались у пацієнтів після пересадки нирки, серця та печінки. Загалом, у хворих після пересадки нирки та серця фармакологічний профіль мофетилу мікофенолат однаковий. В ранньому пост трансплантаційному періоді у пацієнтів після пересадки печінки та отримання мофетилу мікофенолат в дозі 1,5 г, концентрації
2-морфоліноетилового ефіру мікофенолової кислоти такі ж, як у хворих після пересадки нирки, які застосовували мофетилу мікофенолат в дозі 1 г.
Всмоктування.
Після перорального прийому відбувається швидке і повне всмоктування і повний перед системний метаболізм мофетилу мікофенолату з утворенням активного метаболіту мікофенолової кислоти (МФК). Біодоступність мофетилу мікофенолату при пероральному прийомі, відповідно до величини AUCМФК (площа під кривою концентрація-час), становить у середньому 94 % від такої ж при його внутрішньо венному введенні. Після перорального прийому концентрації мофетилу мікофенолату в плазмі не визначаються у зв'язку з його швидким перетворенням в активні метаболіти – 2-морфоліноетиловий ефір мікофенолової кислоти та інші.
У ранньому пост трансплантаційному періоді (до 40 днів після трансплантації нирок, серця або печінки) середні величини AUCМФК були приблизно на 30 %, а максимальні концентрації – приблизно на 40 % нижчими, ніж у пізньому пост трансплантаційному періоді (3 – 6 місяців після трансплантації).
Прийом їжі не впливає на ступінь всмоктування мофетілу мікофенолату (AUCМФК) при його призначенні по 1,5 г два рази на добу хворим після трансплантації нирки. Однак максимальна концентрація 2-морфоліноетилового ефіру мікофенолової кислоти при застосуванні препарату під час їжі знижується на 40 %.
Розподіл.
Як правило, приблизно через 6–12 год після прийому препарату спостерігається вторинне підвищення концентрації 2-морфоліноетилового ефіру мікофенолової кислоти у плазмі, що свідчить про печінково-кишкову рециркуляцію препарату. При одночасному застосуванні холестираміну AUCМФК знижується приблизно на 40 %, що свідчить про переривання печінково-кишкової рециркуляції. У клінічно значимих концентраціях 2-морфоліноетилового ефіру мікофенолової кислоти на 97 % зв'язується з альбуміном плазми.
Метаболізм.
2-морфоліноетиловий ефір мікофенолової кислоти метаболізується в основному під дією глюкуронілтрансфер ази з утворенням фармакологічно неактивного фенольного глюкуроніду 2-морфоліноетилового ефіру мікофенолової кислоти. In vivo глюкоронід 2-морфолінового ефіру мікофенолової кислоти перетворюється у вільний 2-морфоліноетиловий ефір мікофенолової кислоти під час печінково-кишкової рециркуляції.
Виведення.
Незначні кількості препарату (< 1 % дози) виводяться із сечею у вигляді 2-морфоліноетилового ефіру мікофенолової кислоти. Після перорального прийому радіо активно міченого мофетилу мікофенолату 93 % отриманої дози виділяється із сечею, а 6 % – з калом. Значна частина (близько 87 %) введеної дози виводиться із сечею у вигляді глюкороніду 2-морфолінового ефіру мікофенолової кислоти. Концентрації 2-морфоліноетилового ефіру мікофенолової кислоти та глюкороніду 2-морфолінового ефіру мікофенолової кислоти, що визначаються клінічно, не видаляються шляхом гемодіалізу. Проте при вищих концентраціях глюкороніду 2-морфолінового ефіру мікофенолової кислоти (> 100 мкг/мл) деяка його частина може бути видалена. Секвестр анти жовчних кислот типу холестираміну знижують
AUCМФК, перериваючи печінково-кишкову рециркуляцію.
Фармакокінетика в особливих випадках.
В дослідженнях з разовим прийомом препарату у хворих з тяжкою нирковою недостатністю (швидкість клуб очкової фільтрації < 25 мл/хв/1,73 м2) AUCМФК була на 28 – 75 % більше, ніж у здорових добровольців та хворих із менш вираженими ураженнями нирок. Після прийому разової дози AUCМФКГ в 3 – 6 разів більше у хворих з тяжкою нирковою недостатністю, що узгоджується з відомими даними про виведення глюкороніду 2-морфолінового ефіру мікофенолової кислоти печінкою. Досліджень багаторазового виведення мофетилу мікофенолату при тяжкій нирковій недостатності не проводились.
У хворих із затримкою функції ниркового трансплантата після пересадки середнє значення AUC0-12 для 2-морфоліноетилового ефіру мікофенолової кислоти порівняна з такою у хворих, у яких трансплантат починав функціонувати після пересадки без затримування, а середнє значення AUC0-12 для глюкороніду 2-морфолінового ефіру мікофенолової кислоти в плазмі було в 2–3 рази більше.
Хворі з ураженням печінки. У добровольців з алкогольним цирозом печінки після перорального прийому мофетилу мікофенолату не виявлено змін у фармакокінетиці 2-морфоліноетилового ефіру мікофенолової кислоти та глюкороніду 2-морфолінового ефіру мікофенолової кислоти, що вказує на те, що ураження паренхіми печінки не є протипоказанням для призначення мофетилу мікофенолату. Вплив печінкової патології на процес залежить від конкретного захворювання. У випадку захворювання печінки з переважанням ураження жовчних шляхів (наприклад, первинний міліарний цироз) ефект може бути іншим.
У хворих літнього віку (≥ 65 років) фармакокінетика не вивчалась.
Фармацевтичні характеристики.
основні фізико-хімічні властивості: тверді желатинові капсули, корпус – непрозорий, коричневого кольору, ковпачок – непрозорий, синього кольору; маркування чорного кольору: CellCept 250 – на ковпачку та Roche – на корпусі; вміст капсул – гранульований порошок майже білого кольору.
Термін придатності. 3 роки.
Умови зберігання. Зберігати у захищеному від світла, вологи та недоступному для дітей місці; температуру зберігання дивись на упаковці.
Упаковка. 10 капсул по 250 мг у блістері, 10 блістерів у картонній упаковці.
Категорія відпуску. За рецептом.
Виробник. Рош С. п. А., Італія.
Місцезнаходження. Віа Мореллі 2, 20090 Сеграте, Мілан, Італія.
| Кількість переглядів: |