Ліки від а до я -
Хвороби -
Калькулятор калорій -
Магнітні бурі -
Дієти -
Очищення організму -
Схуднення -
Молочниця
Геморой -
Лікування -
Косметологія -
Поради -
Інсульт -
Інфаркт -
Діабет -
Варикоз -
Вправи -
Covid-19
Ліки та препарати
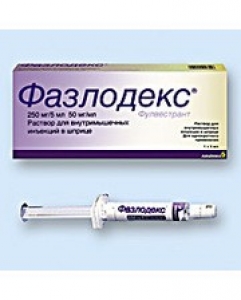
Фазлодекс
Астра Зенека ЮК Лімітед, Великобританія
Інструкція
Загальна характеристика:
міжнародна назва: fulvestrant;
основні фізико-хімічні властивості: прозора, від безбарвного до жовтого кольору, в’язка рідина.
склад: 1 наповнений шприц містить фулвестранту 250 мг;
допоміжні речовини: спирт етиловий (96 %), спирт бензиловий, бензилбензоат, олія рицинова.
Форма випуску. Розчин для ін’єкцій.
Фармакотерапевтична група. Засоби, що застосовуються при гормональній терапії.
Код АТС L02BA03.
Фармакологічні властивості.
Фармакодинаміка.
Фульвестрант є антагоністом естрогенного рецептору. Він конкурентно зв’язується з естроген ними рецепторами за ступенем спорідненості, що може бути порівняно з цим показником ест радіолу. Фульвестрант, не маючи будь-якої часткової агоністичної (естрогеноподібної) активності, блокує трофічну дію естрогенів. Механізм дії пов’язанний з пригніченням активності та деградацією естроген-рецепторів (ER).
Вплив на метастатичний рак грудей
Коефіцієнт небезпеки фульвестранту відносно анастрозолу щодо часу настання смерті дорівнював 1,01 (95 % СІ 0,86–1,19). Аналіз результатів за ER статусом показав, що застосування фульвестранту має бути обмежене пацієнтками, які страждають на рак грудей позитивний до ER.
Вплив на ендометрій у пост менопаузальному періоді
До клінічні дані свідчать, що фульвестрант не буде мати стимулюючий ефект на ендометрій у пост менопаузальному періоді. Двотижневе дослідження за участю здорових добровольців, які перебували у пост менопаузальному періоді, показало, що, у порівнянні з плацебо, попереднє застосування 250 мг фульвестранту у добровольців, які одержували по 20 мг/день етинілест радіолу, призводило до суттєво пониженої стимуляції пост менопаузального ендометрію, про що можна було судити за ультразвуковим вимірюванням товщини ендометрію.
Не існує даних щодо довго тривалого впливу фульвестранту на пост менопаузальний ендометрій. Не існує також даних щодо морфології ендометрії.
Вплив на кістки
Дані щодо довго тривалого впливу фульвестранту на кістки відсутні.
Фармакокінетика.
Абсорбція
Після застосування препарату, фульвестрат абсорбується повільно, максимальні концентрації у плазмі досягаються приблизно через 7 днів. Абсорбція триває більш ніж один місяць, та щомісячне застосування призводить до приблизно двократної акумуляції. Рівні рівноважної концентрації досягаються після введення приблизно 6 доз у режимі щомісячних ін’єкцій, а основна частина акумуляції досягається через 3-4 дози. Кінцевий період напіврозпаду зумовлений швидкістю абсорбції та оцінюється як 50 днів. При рівноважному стані концентрації фульвестранту у плазмі коливаються у незначному діапазоні з приблизно 2–3-х разовою різницею між максимальною та мінімальною концентрацією.
Після внутрішньом’язового введення експозиція є приблизно пропорційною введеній дозі (в інтервалі доз 50 - 250 мг).
Розподілення
Фульвестрант піддається широкому та швидкому розподіленню. Уявний об’єм розподілення при рівноважній концентрації великий (приблизно 3 - 5 л/кг), що свідчить про те, що розподілення сполуки є переважно поза судинним. Фульвестрант значою мірою (99 %) зв’язується з білками плазми. Фракції ліпопротеїну дуже низької щільності (VLDL), ліпопротеїну низької щільності (LDL) та ліпопротеїну високої щільності (HDL) є основними компонентами зв’язування. Роль глобуліну, що зв’язується зі статевим гормоном, не визначена.
Метаболізм
Метаболізм фульвестранту повністю не визначений, проте під час цього процесу мають місце комбінації кількох можливих шляхів біо трансформації, аналогічних тим, які проходять ендогенні стероїди (включаючи 17-кетонний, сульфонний, 3-сульфатний, 3- та 17-глюкуронідний метаболіти). Ідентифіковані метаболіти є або менш активними, або демонструють подібну до фульвестранту активність на анти естроген них моделях. Дослідження з застосуванням препаратів людської печінки та рекомбінантних людських ферментів вказують на те, що CYP 3A4 є єдиним Р 450 ізоферментом, що бере участь в окисленні фульвестранту. Дані, одержані in vitro, свідчать, що фульвестрант не інгібує ізоферменти CYP 3A4.
Виведення
Головний шлях виведення – з фекаліями, менш ніж 1 % виводиться з сечею. Фульвестрант має високий кліренс, 11 +/- 1,7 мл/хв/кг, що свідчить про високий коефіцієнт печінкової екстракції.
Особливі категорії пацієнтів
Не виявлено різниці у фармакокінетичних характеристиках фульвестранту відносно віку
(у межах 33 - 89 років), маси тіла (40 - 127 кг) або раси.
Ниркова недостатність
Недостатність функції нирок від легкого до помірного ступеню тяжкості не впливає на фармакокінетику фульвестранту до будь-якої клінічно значимої міри.
Печінкова недостатність
Фармакокінетика фульвестранту не вивчалася у пацієнтів з печінковою недостатністю.
Показання для застосування.
Місцево-прогресуючий або метастатичний рак молочної залози з позитивними рецепторами естрогенів у жінок в пост менопаузі при прогресу ванні захворювання після або на фоні терапії анти естрогенами.
Спосіб застосування та дози.
Дорослі жінки (включаючи осіб похилого віку)
Рекомендована доза становить 250 мг на добу 1 раз на місяць.
Діти та підлітки
Фазлодекс не рекомендований для застосування дітьми та підлітками.
Пацієнти з нирковою недостатністю
Для пацієнтів, які страждають на ниркову недостатність від легкого до помірного ступеню тяжкості (кліренс креатині ну ≥ 30 мл/хв), коригування дози не потребується. Ефективність та безпечність лікарського засобу не оцінювались у пацієнтів з тяжкою нирковою недостатністю (кліренс креатині ну < 30 мл/хв).
Пацієнти з печінковою недостатністю
Фазлодекс слід з обережністю застосовувати при лікуванні пацієнтів з печінковою недостатністю від легкого до помірного ступеню тяжкості. Ефективність та безпечність лікарського засобу не оцінювались у пацієнтів з нирковою недостатністю.
Спосіб застосування
Застосовують внутрішньом’язово, повільно вводячи в сідницю.
Рекомендації щодо застосування:
Дістаньте скляний корпус шприца з картриджу та перевірте щодо відсутності пошкоджень.
Зніміть зовнішню упаковку безпечної голки “SafetyGlide”(Інструкції щодо безпечної голки див. нижче).
Зламайте печатку білого пластикового ковпачка на сполучній частині шприца Люера, щоб видалити ковпачок з приєднаною резиновою насадкою (див. мал. 1). Прокрутіть, щоб закріпити голку на сполучній частини Люера.
Мал. 1.
Видаліть захисний ковпачок голки.
Перед застосуванням парентеральні розчини слід перевіряти щодо наявності часток та зміни кольору.
Видаліть надлишок газу зі шприцу (може залишитися невелика булька газу). Застосувати внутрішньом’язово, повільно вводячи в сідницю.
Негайно після виведення голки з тіла пацієнта активуйте пристрій для захисту голки, надавлюючи плече важеля вперед до упору, поки кінчик голки не буде повністю закритий (див. мал. 2).
Активувати після ін’єкції
Мал. 2.
Візуально перевірте, щоб плече важеля було повністю виведене вперед та щоб голка була повністю закрита. Якщо не вдасться активувати систему захисту голки, негайно викиньте голку у спеціальний контейнер для гострих пристроїв.
Інформація стосовно “SafetyGlide” :
Застереження: не піддівайте безпечну голку дії автоклаву перед застосуванням. Під час застосування та утилізації руки мають постійно знаходитися за голкою.
Вказівки щодо застосування безпечної голки
Зніміть упаковку безпечної голки, зламайте печатку білого пластикового ковпачка на сполучній частині шприца Люера та приєднайте безпечну голку до замку Люера на шприці круговими рухами.
Перенесіть шприц до місця застосування.
Прямим рухом, щоб уникнути ушкодження кінчика голки, зніміть захисний ковпачок з голки.
Застосовуйте ін’єкцію згідно з інструкціями на упаковці.
Для зручності користувача „скос” голки направлений до плеча важеля, як зображено на
Площина скосу = Розташування важеля
Мал. 3.
Негайно після виведення голки з тіла пацієнта активуйте пристрій для захисту голки, надавлюючи плече важеля вперед до упору, поки кінчик голки не буде повністю закритий (див. мал. 2).
Візуально перевірте, щоб плече важеля було повністю виведене вперед та щоб голка була повністю закрита. Якщо не вдасться активувати систему захисту голки, негайно викиньте голку у спеціальний контейнер для гострих пристроїв.
Активація захисного механізму може спричинити мінімальне виливання рідини, що могла залишися у голці після ін’єкції.
Для найбільшої безпеки застосовуйте методику „однієї руки” та активуйте поодаль від себе та інших людей.
Після одноразового застосування утилізуйте у схваленому контейнері для гострих пристроїв у відповідності до діючих директив установи.
Побічна дія.
Найчастіше повідомлялося про такі побічні реакції, як припливи, нудота та реакції у місці ін’єкції. Побічні реакції узагальнені нижче:
Система організму/ частота Дуже поширені
(> 1/10) Поширені
(>1/100, < 1/10) Непоширені
(> 1/1000, < 1/100)
Серцево-судинна - припливи
Шлунково-кишкова - шлунково-кишкові розлади, включаючи нудоту, блювання, діарею та анорексію
Гепатобіліарні порушення -підвищений
рівень печінкових ферментів
Репродуктивна система та груди - піхвова кровотеча;
- піхвовий моніліаз;
- лейкорея
Шкіра - висипи - реакції гіпер чутливості, включаючи ангіо невротичний набряк та кропивницю
Сечостатева - інфекції сечовивідних шляхів
Судинна - венозна тромбоемболія
Інші реакції -реакції на місці ін’єкції, включаючи тимчасовий біль та запалення, а також
- головний біль
- астенія
- біль у спині
Протипоказання.
Фазлодекс протипоказаний у наступних випадках:
пацієнтам з відомою гіперчутливістю до діючої речовини або будь-якої з допоміжних речовин;
у період вагітності та годування груддю;
тяжка печінкова недостатність.
Передозування.
Досвід передозування у людей відсутній. Дослідження на тваринах свідчать, що високі дози фульвестранту не викликали інших ефектів крім тих, що прямим або непрямим чином пов’язані з анти естрогенною дією. У випадку передозування, призначають симптоматичну терапію.
Особливості застосування.
Фазлодекс слід з обережністю застосовувати пацієнтам з печінковою недостатністю від легкого до помірного ступеню тяжкості.
Фазлодекс слід з обережністю застосовувати пацієнтам з тяжкою нирковою недостатністю (кліренс креатині ну менш, ніж 30 мл/хв).
Фазлодекс слід з обережністю застосовувати при лікуванні пацієнтів, які страждають на кровоточивий діатез, тромбоцит опенію, або тих, хто приймають антикоагулянти.
У жінок, які страждають на прогресуючий рак грудей, зазвичай спостерігаються тромбоемболічні явища. Це слід враховувати при призначенні Фазлодексу пацієнтам, які входять до групи ризику.
Не існує даних довгострокових досліджень щодо впливу фульвестранту на кістки. Через механізм дії фульвестранта існує потенційний ризик розвитку остеопорозу.
Застосування у період вагітності та лактації
Фазлодекс протипоказаний у період вагітності.
Якщо пацієнтка завагітніла у період лікування Фазлодексом, її слід поінформувати про потенційний ризик для плоду і потенційний ризик зриву вагітності.
Враховуючи можливість виникнення серйозних побічних реакцій, спричинених фульвестрантом, у немовлят, яких годують груддю, годування груддю протипоказане у період прийому цього лікарського засобу.
Вплив на здатність керувати автомобілями та застосовувати механізми
Фазлодекс не впливає або має незначний вплив на здатність керувати автомобілями або використовувати механізми. Проте повідомлялося про випадки астенії у період лікування Фазлодексом. Тому пацієнткам, які відчувають цей симптом під час керування автомобілем або використання механізмів, слід дотримуватися обережності.
Взаємодія з іншими лікарськими засобами.
Дослідження клінічної взаємодії з мідазоламом продемонструвало, що фульвестрант не інгібує CYP 3А 4.
Дослідження клінічної взаємодії з рифампіцином (індуктором CYP 3А 4) та кетоконазолом (інгібітором CYP 3А 4) не показали клінічно значимих змін у кліренсі фульвестранту.
Таким чином, для пацієнтів, яким одночасно призначені фульвестрант та інгібітори або індуктори CYP 3А 4, коригування дози не потрібне.
Несумісність
За відсутності досліджень несумісності, цей лікарський засіб не слід змішувати з іншими лікарськими засобами.
Умови та термін зберігання.
Зберігати в захищенному від світла місці при температурі 2 – 8 °С.
Зберігати в місцях недоступних для дітей.
Термін придатності – 4 роки.
Умови відпуску. За рецептом.
Упаковка. 1 картонна коробка містить. 1 шприц з безпечною системою введення, що містить 5 мл розчину та 1 запечатану безпечну стерильну голку “SafetyGlide” у контурній чарунковій упаковці що запечатана поліпропіленовою плівкою.
Виробник/заявник.
Астра Зенека ЮК Лімітед, Великобританія вироблено
Веттер Фарма-Фертигун ГмбХ & Ко. КГ, Німеччина.
Адреса.
Шутценштрассе 87, Д-88212, Равенсбург, Німеччина/
Schutzenstrasse 87, D-88212, Ravensburg, Germany.
| Кількість переглядів: |